オンコリスバイオファーマのニュース
【QAあり】オンコリスバイオファーマ、テロメライシンの2024年承認申請に向けて、製造・販売体制の整備が順調に進捗
目次 Agenda

浦田泰生氏(以下、浦田):オンコリスバイオファーマ株式会社の2023年12月期中間決算説明会を行います。
本日は、吉村取締役より決算ハイライトをご報告し、その後、当社主力開発品「テロメライシン」の開発状況を中心に、株主総会でお伝えした「6つのご期待頂きたいこと」の現状についてお話しします。
財政状態の概況
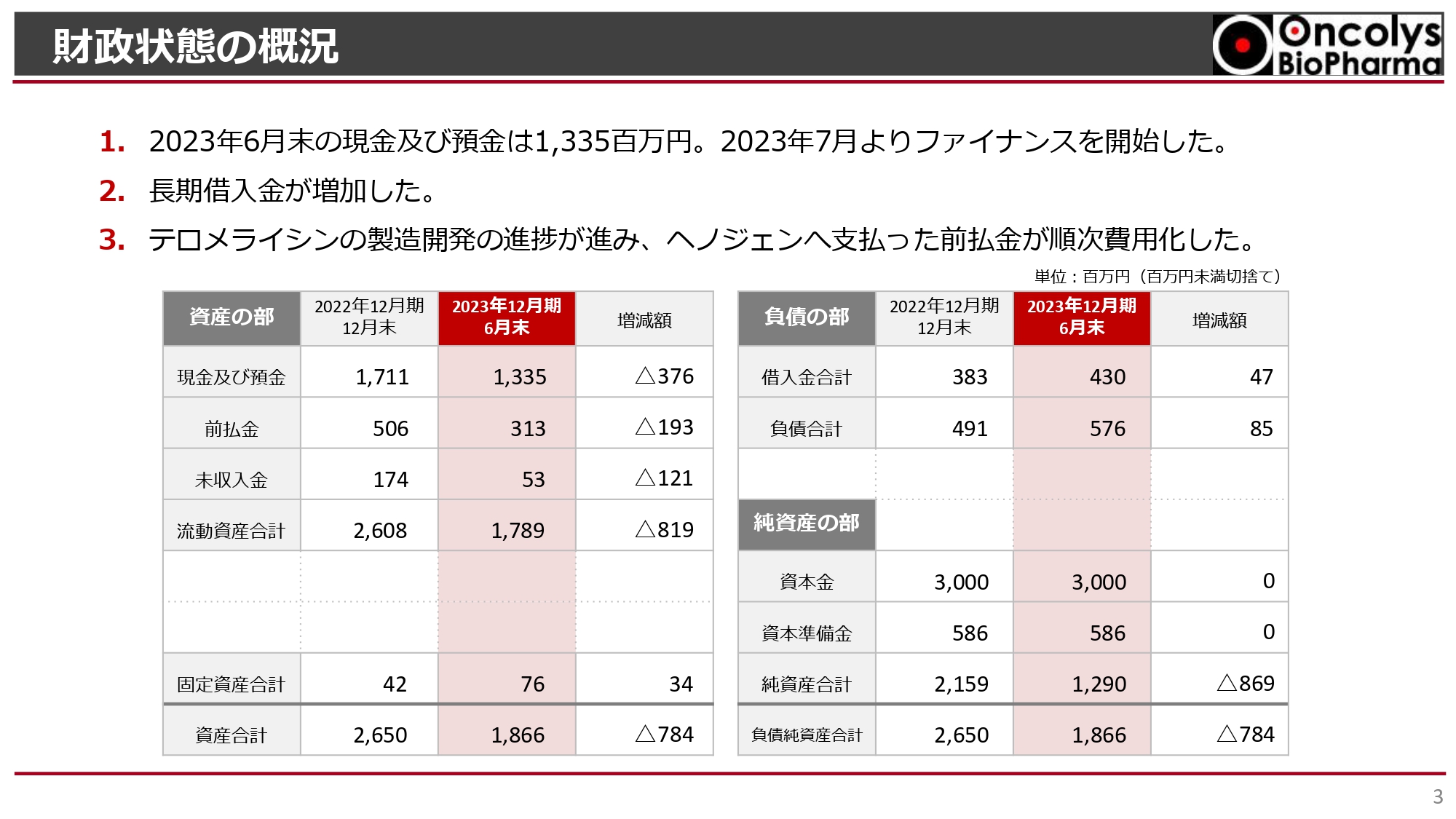
吉村圭司氏(以下、吉村):財政状態の概況です。2023年6月末の現金及び預金残高は13億3,500万円です。また、ご案内のとおり、2023年7月25日からファイナンスを開始しました。
負債に関して、返済は進んでいますが、借り換えに応じていただけるということで、長期借入金が若干増加しています。
前払金が若干減少しているのは、「テロメライシン」の製造開発が進み、さまざまな作業が順次終了したことにより、ヘノジェン社へ支払った前払金を費用化したためです。これは、開発が進んでいる根拠となります。
経営成績の概況
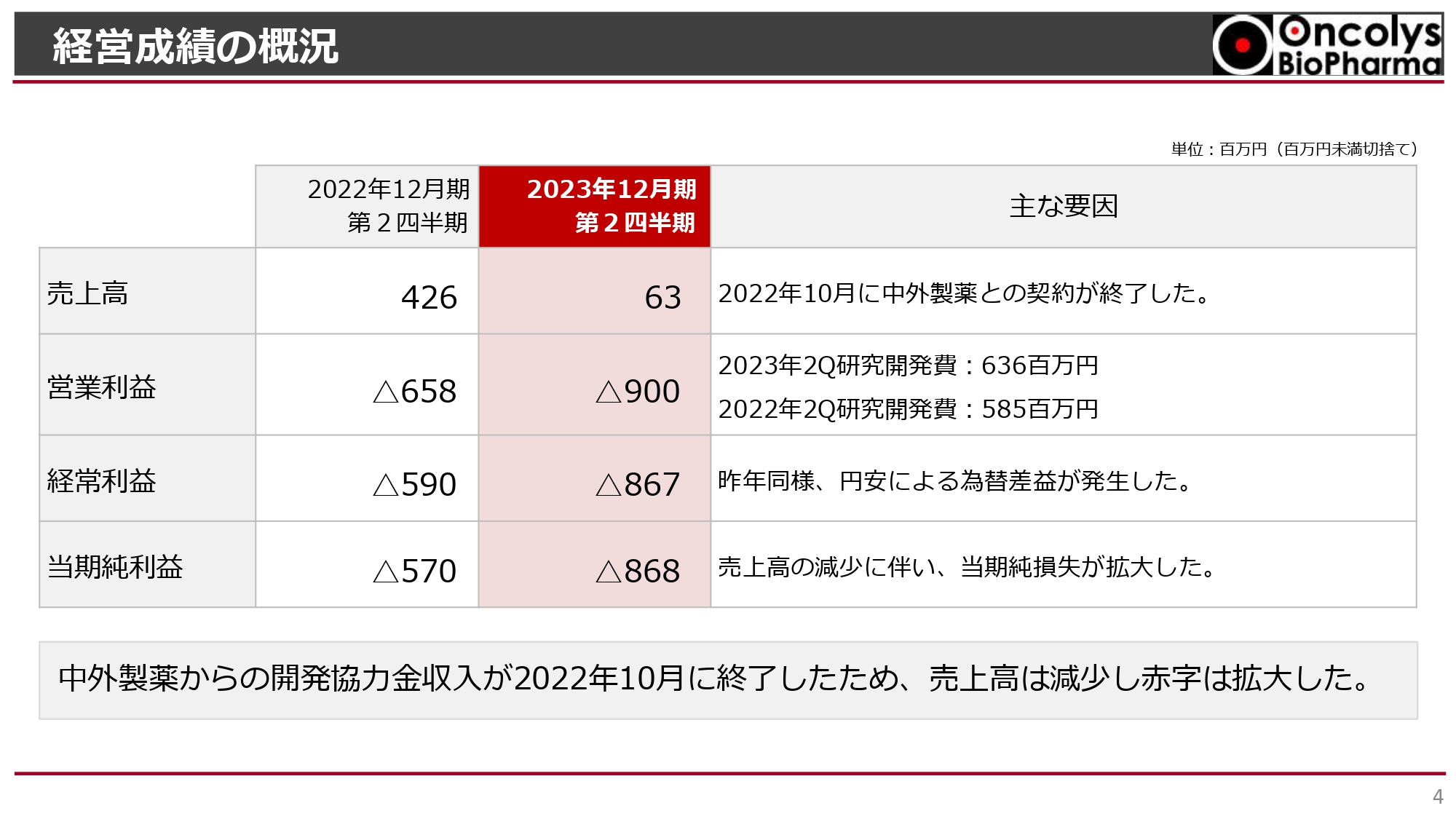
経営成績の概況です。売上高は6,300万円です。前年同期の4億2,600万円には、中外製薬からの開発協力金が含まれておりましたが、2022年10月にその契約が終了し、6,300万円の売上高にとどまっています。
また、売上高が減少したことにより、売上総利益が減少しています。それに加えて、研究開発費が2022年第2四半期の5億8,500万円から2023年第2四半期の6億3,600万円と増加したことにより、営業利益がマイナス9億円となっています。
ただし、経常利益は、昨年度も今年度も改善しています。これは円安による為替差益が昨年同様に発生したことによります。
総じて、当期純利益はマイナス8億6,800万円で、当期純損失は拡大しました。
キャッシュ・フローの概況
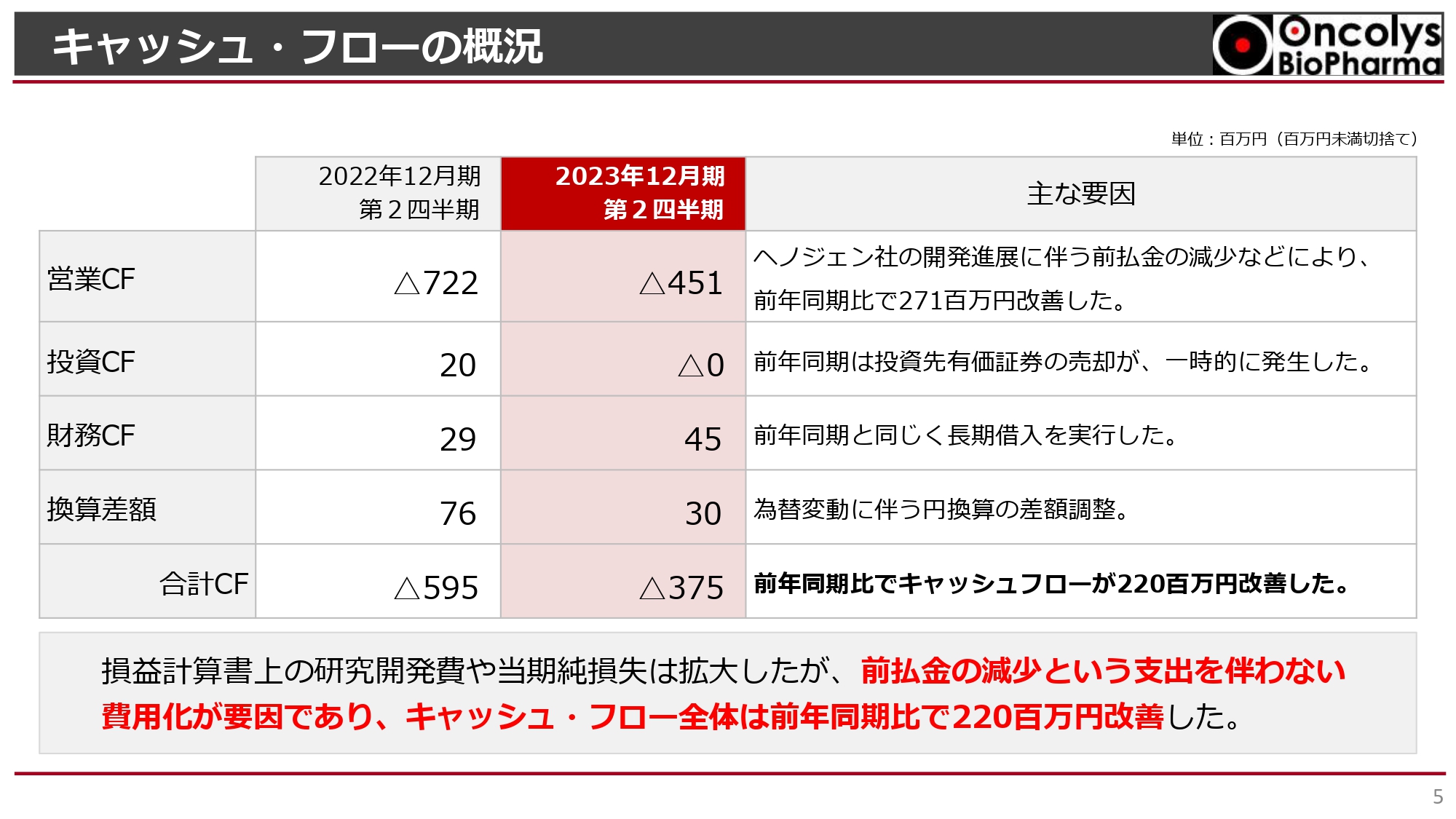
キャッシュ・フローの概況です。営業キャッシュ・フローについては、前払金の減少に伴う費用化が進んだことによる損失の増加のため、前年同期比で2億7,100万円の改善が見られています。
スライド下部に記載したとおり、合計キャッシュ・フローはマイナス3億7,500万円でした。当期純損失約8億円に対して、実際には4億円弱のキャッシュアウトにとどまりました。キャッシュ・フロー全体としては、前払金の減少という、支出を伴わない費用化が要因のため、前年同期比で2億2,000万円改善したと言えます。
2023年の業績見通し
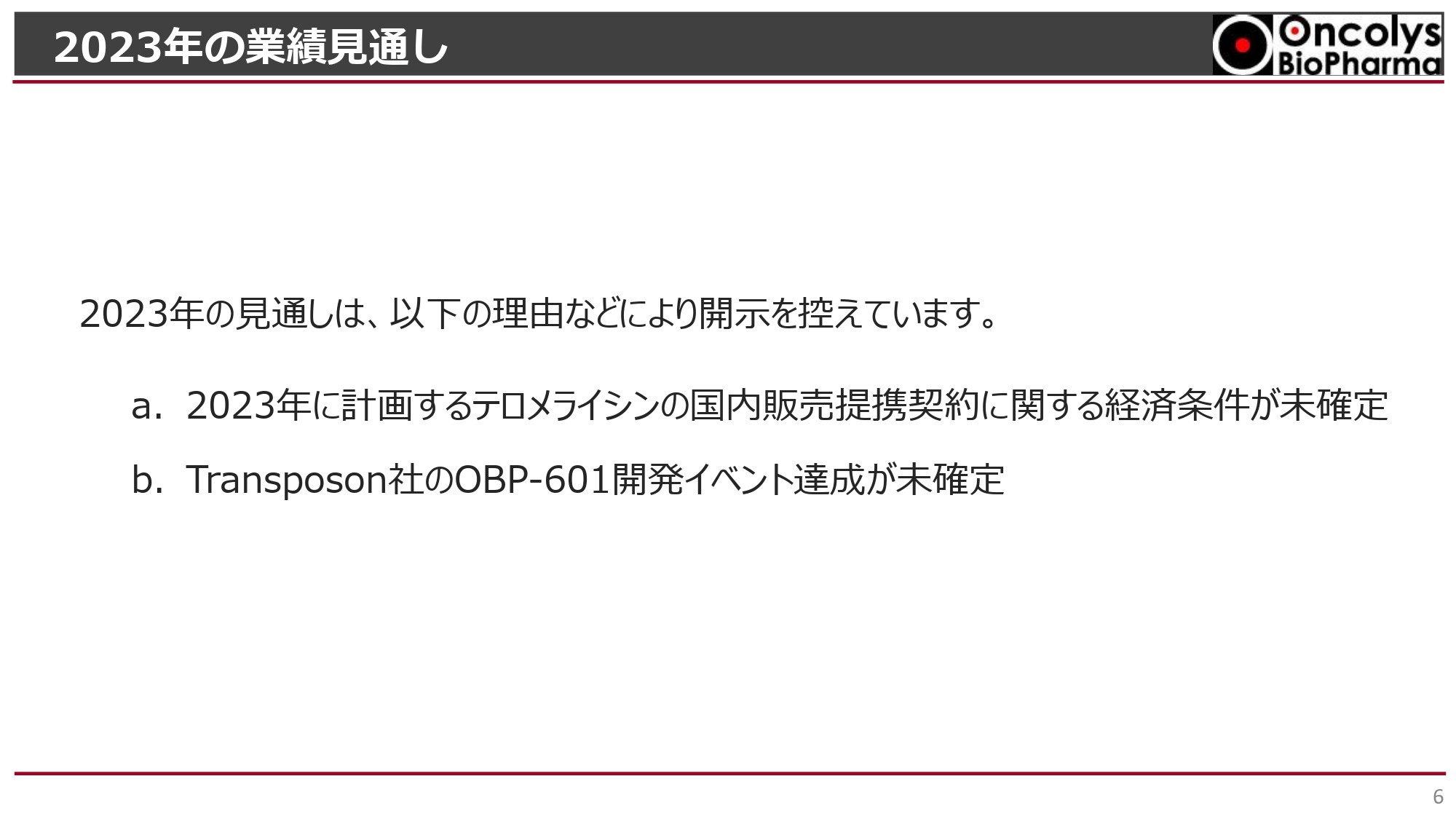
2023年の業績見通しです。本日(2023年8月4日)公表した決算短信でも述べていますが、今期に計画している「テロメライシン」の国内販売提携契約に関する経済条件が未確定である点、Transposon社にライセンスアウトした「OBP-601」開発のイベント達成時期が未確定である点、この2点により今期の見通しについては開示を控えています。
パイプライン一覧
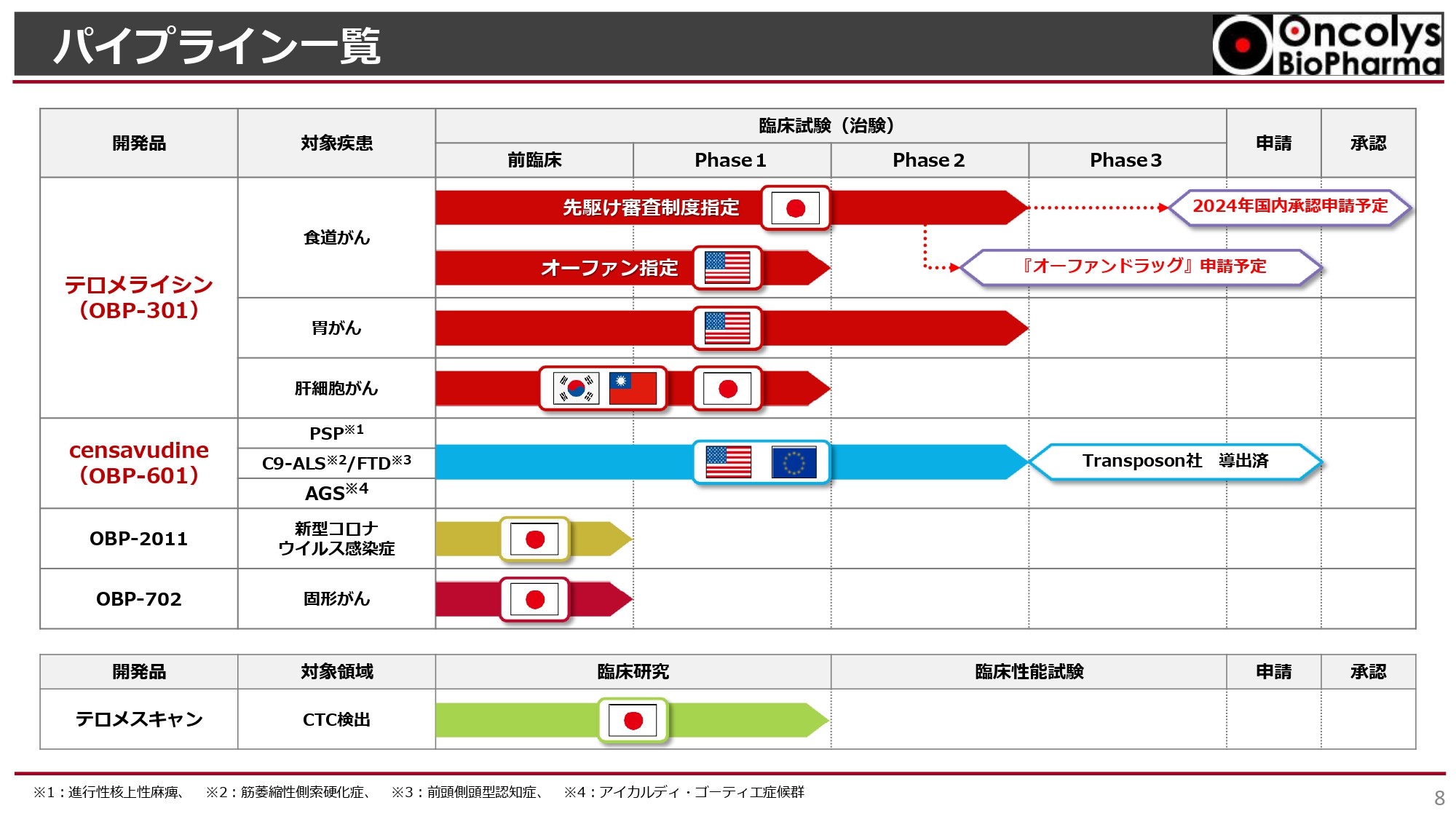
浦田:今期は「テロメライシン」の開発が来るところまで来たという状況です。株主総会でもお伝えした「6つのご期待頂きたいこと」に関して、おさらいとともに、今後の見通しについてお話しします。
まずは、パイプラインの状況です。スライド上部をご覧ください。「テロメライシン」は、食道がん、胃がん、肝細胞がんの臨床試験が進んでおり、食道がんについては、2024年に国内承認申請予定です。
「censavudine」は、抗HIV薬からドラッグリポジショニングを行い、現在は神経難病治療薬として開発しています。今回はこの2つのパイプラインを中心にお話ししたいと思います。
2023年にオンコリスにご期待頂きたいこと

こちらが、株主総会でお話しした、2023年にオンコリスにご期待いただきたい6つのトピックスです。1番目は、現在行っている「テロメライシン」のpivotal studyで、放射線併用の食道がんのトップラインデータを公表することをお約束しています。
2番目は、「テロメライシン」商用製造法を確立して、来年度の商用製造に向かいたいとお話ししています。
3番目は、「テロメライシン」の製造販売体制を確立することをお約束しています。
4番目は、「テロメライシン」の国内販売パートナーとの提携です。当社は研究開発型のベンチャー企業のため、現段階では、MRを中心とした国内販売体制は持っていませんが、国内企業と連携することで「テロメライシン」のマーケットを十分に拡大できるような体制を整備するとお話ししています。
5番目は、アメリカで「テロメライシン」の胃がんの臨床試験を行っており、初期の臨床試験で良い結果が出たため、今後、海外の製薬企業との共同開発体制を構築していくことをお約束しています。
6番目は、「OBP-601」は、PSP(進行性核上性麻痺)という神経難病に対して臨床試験が進められています。このトップラインデータもライセンスアウト先の意向に応じて公表していきたいとお話ししています。
これらについて、それぞれの状況及び今後のことについて、ご報告したいと思います。
食道がん放射線Phase2 トップラインデータ公表
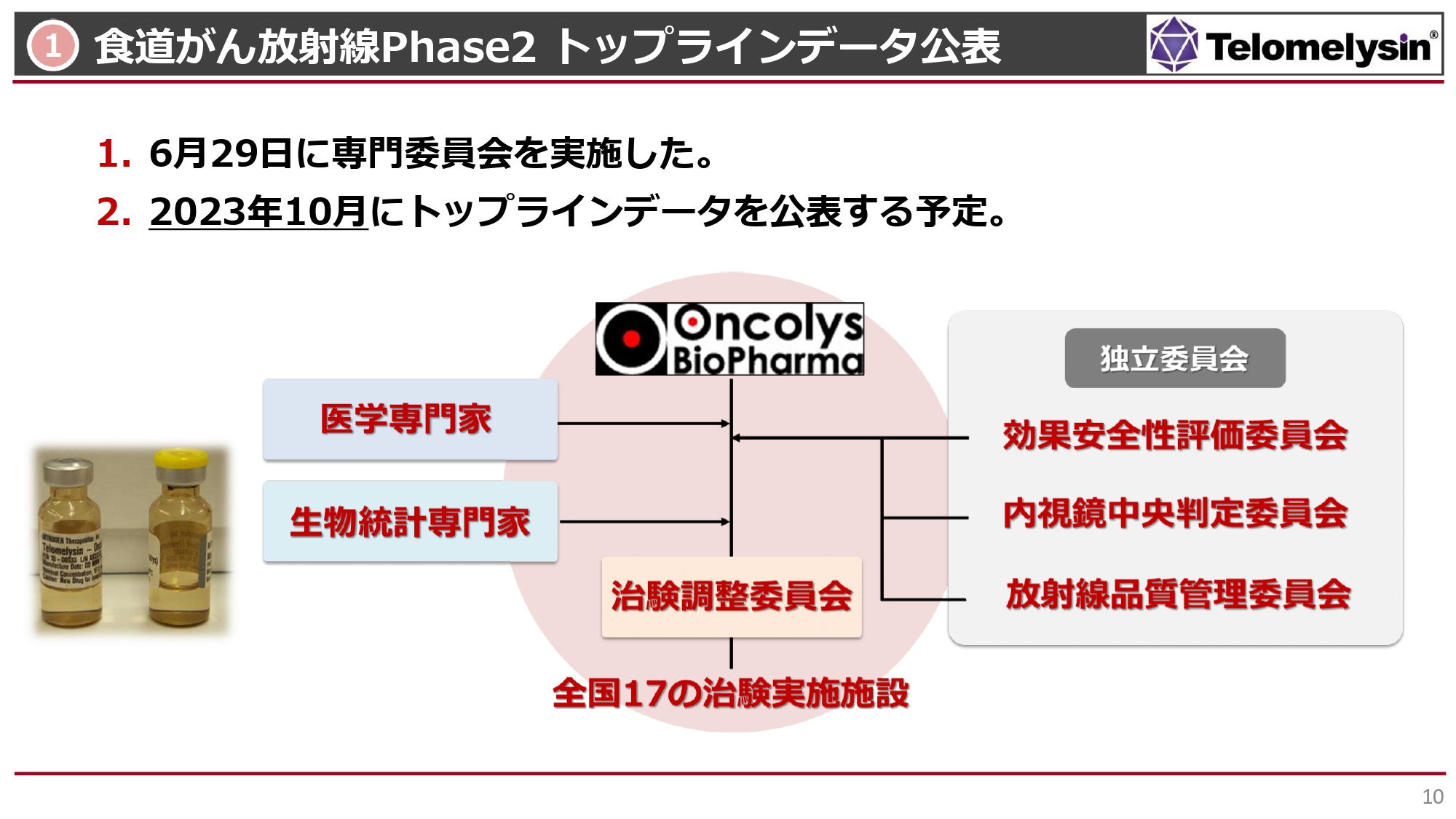
食道がんの放射線併用のPhase2臨床試験についてです。中外製薬がスタートを切り、その後、我々にバトンタッチして、日本国内における17の主要ながんの臨床施設において臨床試験を行ってきました。最終的に36例が使えるようになったという結果が出ています。
6月29日には専門家の先生方にお集まりいただき、今後どのようにデータを固定して公表していくべきかについて話し合っています。現段階では内視鏡中央判定委員会による判定がほぼ終了し、こちらのデータがインプットされている状況です。それ以外にも、データの固定を進めています。
今、我々が直面している課題は、食道がんに対する放射線単独治療の臨床試験が、これまで国内でほとんど行われてこなかったということです。基本的な生存率のデータや、局所の治癒率についての科学的な論文がほとんどありません。
このような中で、我々が今後得られるであろう結果をどのように主張していくのか、その方法論について、効果安全性評価委員会の先生方や、医学専門家である岡山大学の藤原先生、あるいは生物統計の専門家の先生方と打ち合わせています。
データが出たらすぐにみなさまに公表したいと思っていますが、最終的にどのように公表するかについては、10月に先生方の了解を得たいと考えています。
これまで岡山大学で実施してきた臨床試験では、Stage2からStage3の患者さまのうち55パーセントで、局所のがんが消えました。また、食道学会が出しているコントロールデータでは、放射線単独による局所の完全寛解率は27パーセントとなっています。
このようなコントロールデータ等と比較し、岡山大学のデータがきちんと再現されているかどうかが、今後、データ公表に向かう時の一番大きな基準になってくると考えています。
商用製造法の確立(製造)

商用製造法の確立についてです。これまで3ロットほど作ってきましたが、商用規模での原薬のGMP製造は今年2月から行っています。今朝、GMP製造の最終製剤の品質試験結果が出ました。いずれも品質基準に合致するということで、この原薬GMP製造がきちんと通ったことがわかりました。
もちろん、最終製剤のすべてのデータが出たわけではありませんが、一番我々が心配していたウイルス活性、そして、本当にウイルスがちゃんと入っているのかについてはうまくいったと考えています。
このように原薬GMP製造が完了したため、いよいよ今年度の11月からプロセスバリデーションが開始されることになります。これは非常に重要な工程です。これまで得られた製造プロセスにはさまざまな条件があり、本当にその条件どおりに製造できるのかということを確認するスタディです。
具体的に、「テロメライシン」の製造では、細胞を拡大培養して、その後培養した細胞にウイルスを加えます。我々はそこからウイルスを回収して、余分な細胞成分を除去し、液体クロマトグラフィーでウイルスを精製して、フィルタによって無菌化し、最終的にバイアルに充填して製剤最終化するという工程をたどっています。
この工程の最終的な品質チェックは、来年の2月あるいは3月くらいまでかかると考えていますが、これらがうまくいった場合には、2024年にいよいよ本格的な商用製造がスタートします。現在はベルギーにあるヘノジェン社と、このプロセスバリデーションが順調に進むかどうかの最終チェックを何度も重ねている状況です。製造は着々と進んでいます。
商用製造法の確立(流通)
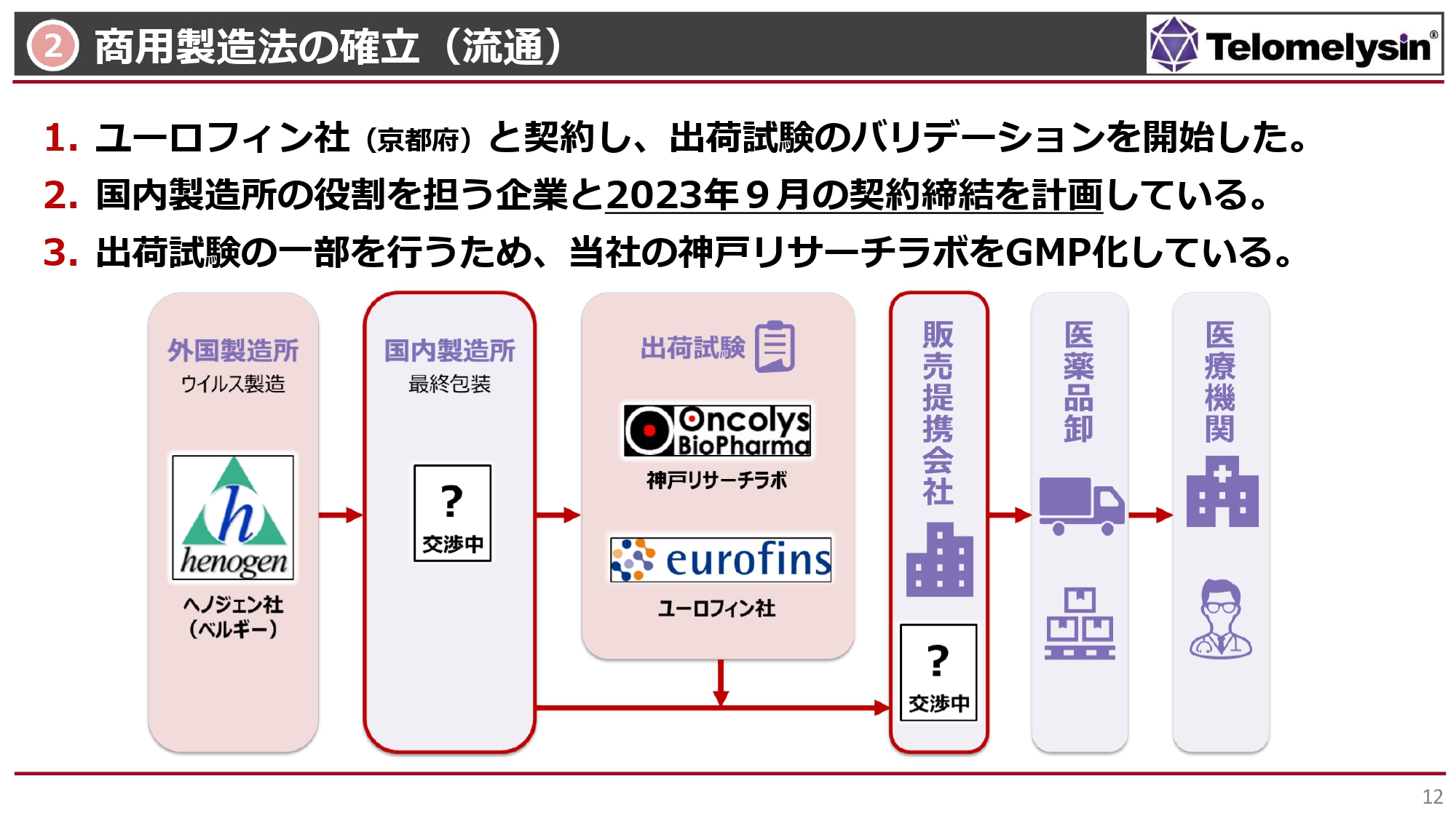
最終的な国内製剤化についてです。外国製造所のヘノジェン社において、作製したウイルスの入った原液を作り、バイアルに分注します。その後、国内に入ってきて、最終的にバイアルを箱詰めして、出荷できる状態にするという意味で、スライドには国内製造所と記載しています。まだ契約には至っていませんが、国内製造所の役割を担う企業として、現在1社と交渉しています。
最終製剤の出荷試験は、京都にあるユーロフィン分析科学研究所、あるいは当社自身が行います。神戸リサーチラボでは現在、GMP化を行い、ウイルスの活性をチェックできるような体制を整えています。このような条件が整うと、いよいよ販売提携会社と組んで医薬品卸、医療機関へと物が運ばれるという順序をたどることになります。
国内製造所と販売提携会社は条件交渉の最終段階に入っており、現段階では未定ですが、年内には両方とも決めたいと考えています。特に国内製造所は非常に重要な役割のため、当社としては9月中に契約締結したいと考えています。ユーロフィン社とはすでに契約済みで、出荷試験のバリデーションをスタートしています。
また、先ほどもお話ししましたが、出荷試験ができるように、現在、神戸リサーチラボをGMPに準拠した体制に整えている状況です。こちらも順調に一歩一歩進んできています。
3 製造販売体制の確立
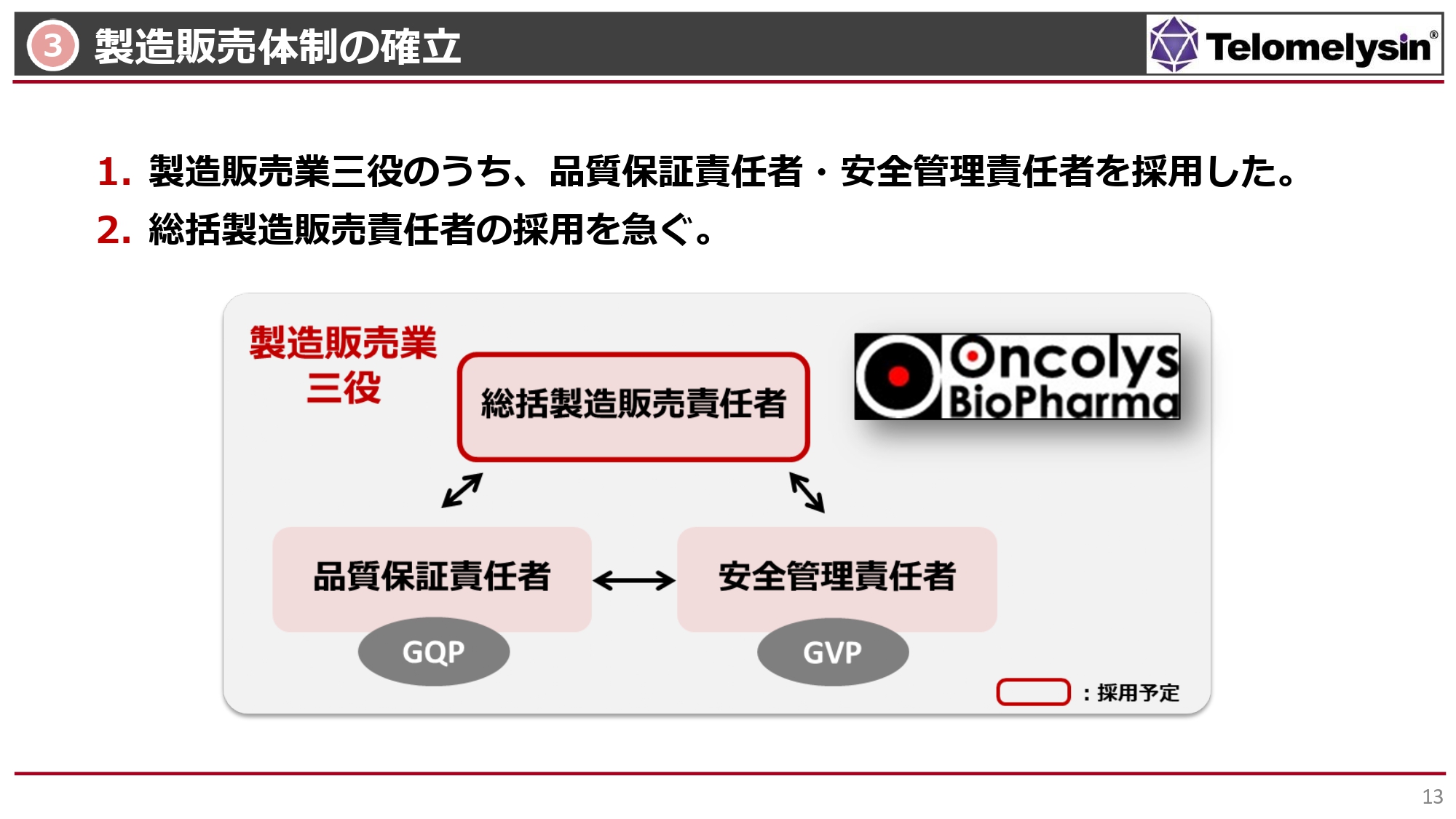
国内での製造販売体制の確立についてです。「テロメライシン」の承認申請を出す段階においては、当社も製造販売業者となりますので、その許可を受けることになります。
そのために、製造販売業三役の採用を進めています。総括製造販売責任者を中心に、品質保証責任者、安全管理責任者を雇用することで、ファーマコヴィジランス、いわゆる市販後でもきちんと安全性を管理できる体制をとらなければなりません。販売は外部に委託する予定ですが、当社の中にもこのような体制を整えなければならないという状況です。
品質保証責任者、安全管理責任者はすでに採用できており、総括製造販売責任者については、候補が何人か出てきている状況です。最終的に年内には決定して、来年の承認申請時にはしっかり体制ができている状況に持っていきたいと考えています。
4 国内販売パートナーとの提携
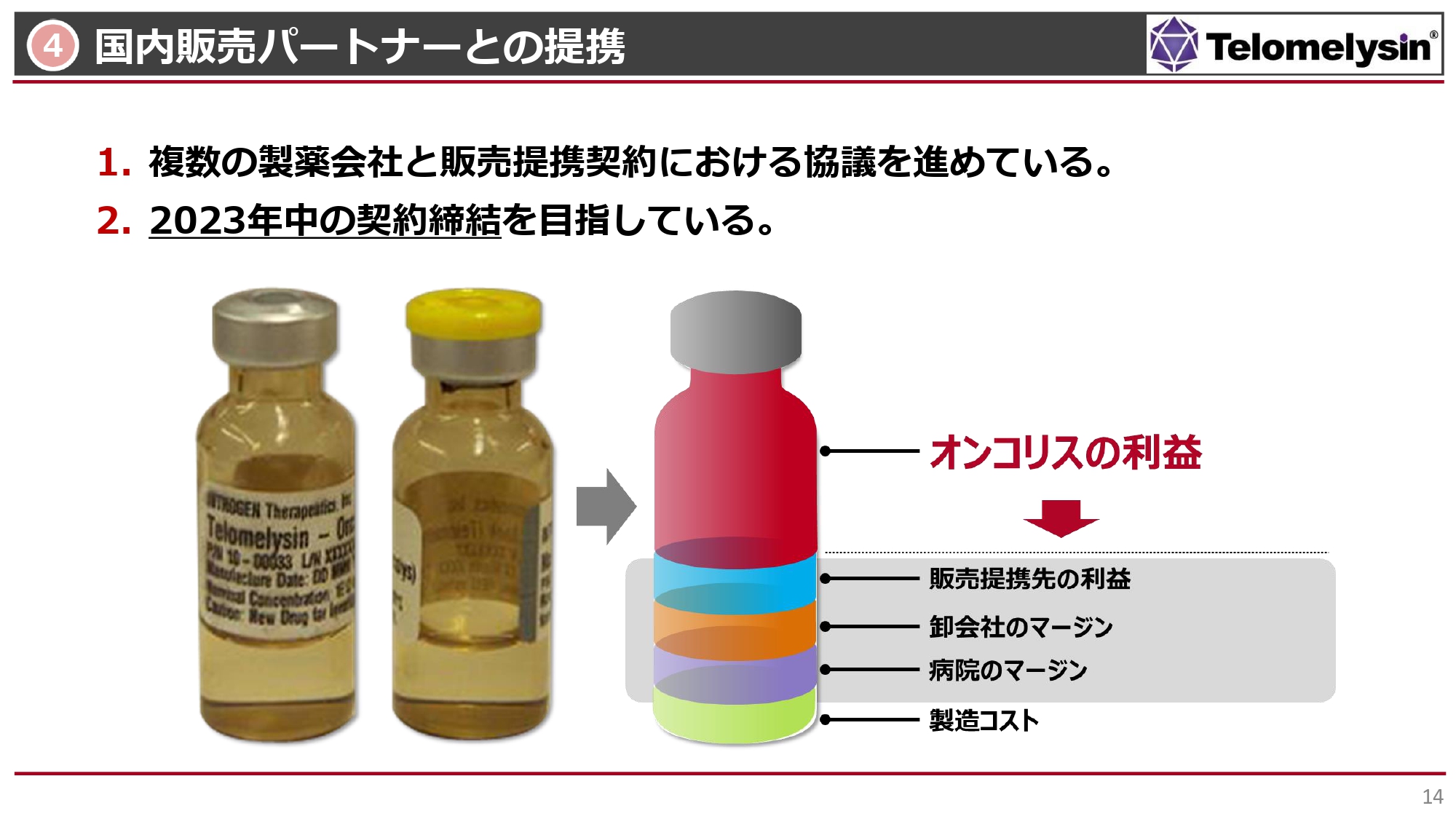
我々が今一番苦心しているのは、国内販売パートナーとの提携です。現在、複数の製薬会社と販売提携契約を進めており、条件交渉に入っています。
医薬品の製造から患者さまに届くまでの流通過程において、薬価が決まるのは承認よりも後になりますが、ヘノジェン社による製造費用以外にも販売会社の販売費としての利益、卸の利益、あるいは病院自体もマージンがかかります。
実際に当社が、黒字化を目指していく上で、妥当な利益を得られるかどうか、日々、提携候補先の企業さまとお話ししています。この条件はまだ詰まっていない状況ですが、少なくとも年内には投資家のみなさまにお話しできればと考えています。
5 胃がんにおける海外製薬会社との共同開発体制の構築
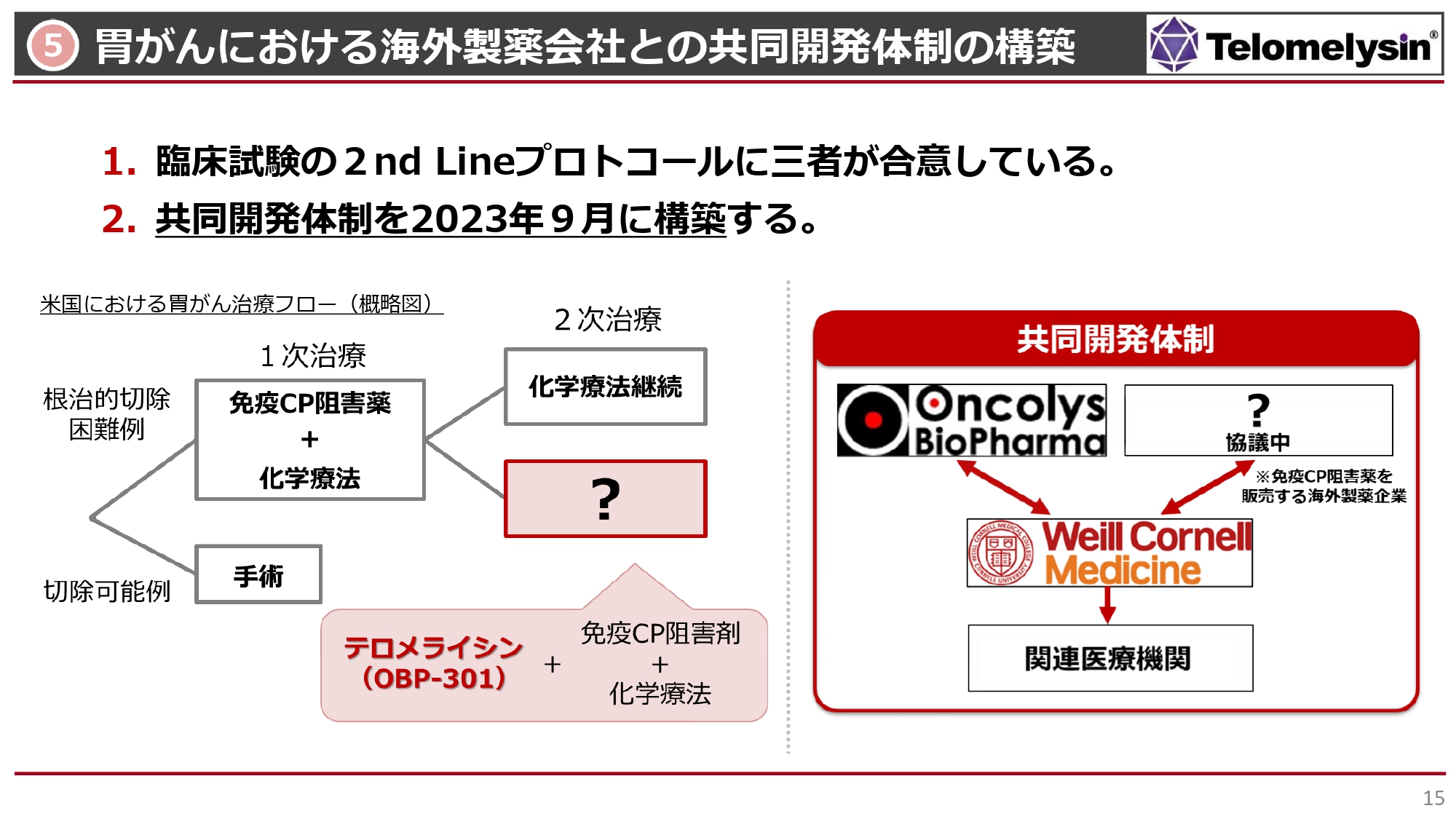
海外製薬企業(アメリカ)との胃がん臨床試験の共同開発体制の構築についてです。これまでは、Stage3からStage4の進行した胃がんでの治療として、「テロメライシン」と「ペムブロリズマブ」を併用していました。 すでに米国臨床腫瘍学会ASCOでも報告されたとおり、16例中3例の長期生存が認められ、非常に評価されている状況です。現在、アメリカでの胃がん治療は、胃がんがStage4まで進行すると、切除できるかどうかを考えます。切除可能であればもちろん手術をしますが、どちらかというと手術はStage2、Stage3までの段階となります。
我々は、免疫チェックポイント阻害剤「ペムブロリズマブ」などとの併用を行ってきましたが、その後にさまざまな臨床データが出て、1次治療では免疫チェックポイント阻害剤と化学療法を併用して使うことが、アメリカのガイドラインで決まってきました。
そのような意味では、我々が1次治療で使える可能性は若干低くなってきました。つまり化学療法ではなく、「テロメライシン」を1次治療において「ペムブロリズマブ」に併用する治療法は、今のアメリカのガイドラインには沿わなくなってきました。
しかし、アメリカのガイドラインでは、「1次治療でだめだった人はどうするのか?」という2次治療の基本治療は、化学療法の薬剤を変えて維持していくような治療方法しかなく、実はこの2次治療は、新薬としては空席になっています。今回の共同開発体制における臨床試験では、「テロメライシン」と1次治療の免疫チェックポイント阻害剤と化学療法を3つ組み合わせることによって、免疫チェックポイント阻害剤と化学療法が効かなくなった患者さまの2次治療に使えるのではないかと考えました。
実際にコーネル大学の試験では、免疫チェックポイント阻害剤と「テロメライシン」の併用において、1例の方が再び免疫チェックポイント阻害剤が効くようになったという免疫療法の再活性化を示唆するデータがあります。
これを逃すと、この胃がんの患者さまは末期の治療をするしかなくなるため、もし他の治療で少しでも患者さまを救える結果が出れば、マーケットとして「テロメライシン」がしっかり認識される可能性があると考えて話を進めてきました。その考え方は、少なくともオンコリスバイオファーマ、コーネル大学、アメリカの大手製薬メーカーの間では合意が得られています。
さらに、コーネル大学に考案していただいたセカンドライン治療の臨床試験プロトコルについても、基本的に3者が合意しています。この状況の中で、3者がどのような役割をするか等の最終調整に入っており、大手製薬メーカーとの共同開発体制も、今年度9月には最終的にしっかりと契約して、みなさまにご報告できる状況になると考えています。
6 PSP(進行性核上性麻痺)Phase2a トップラインデータ取得
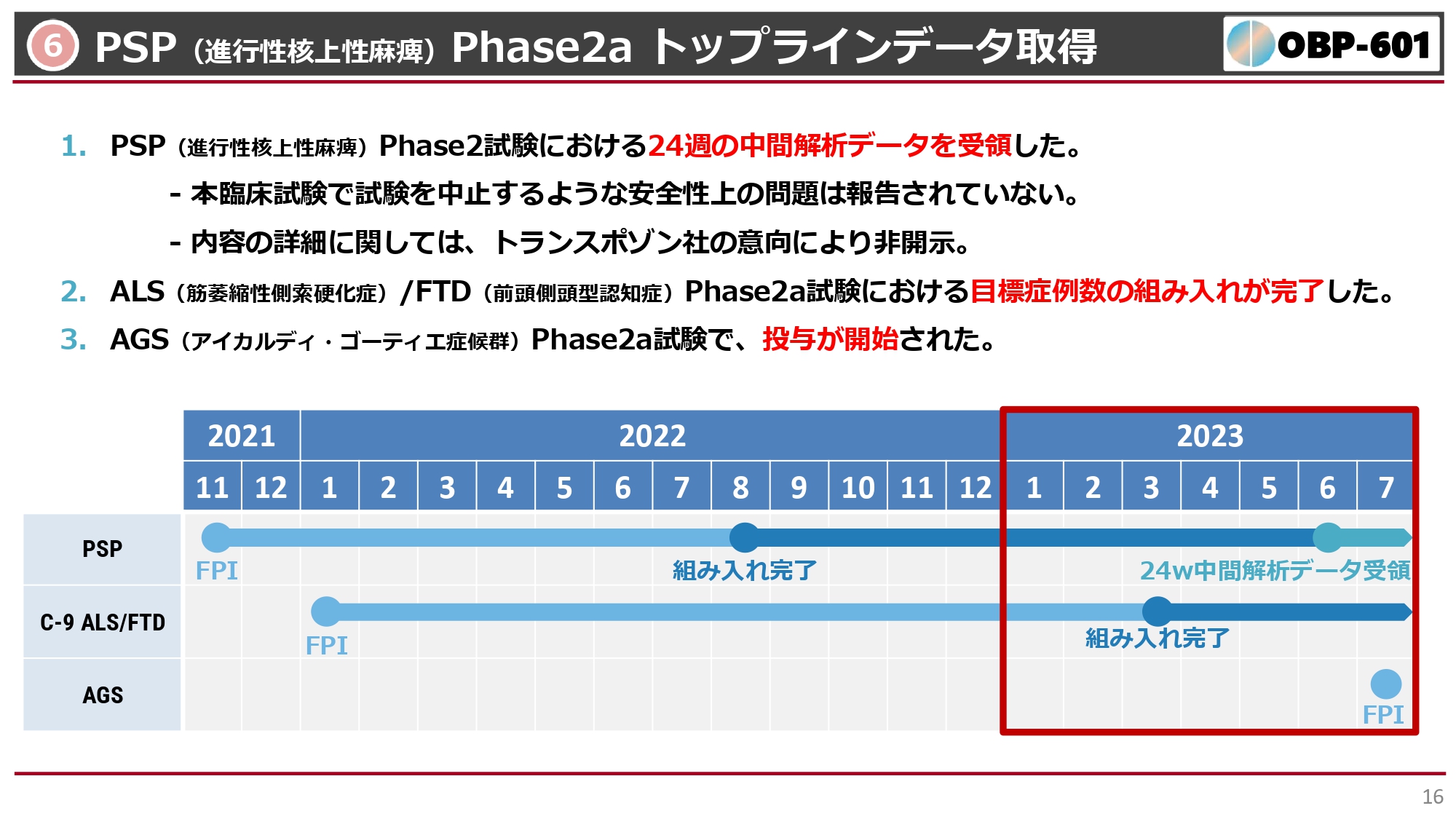
「OBP-601」は、もともと抗HIV剤として開発していた化合物ですが、現在難病治療薬としてアメリカのTransposon社に開発をすべて引き受けていただいています。特に、スライドの一番上に記載しているPSPは、日本での患者数は1万人程度、少し手が震える、歩いているとすぐ転んでしまうなどの症状が出る病気なのですが、まったく治療薬がありません。震えの症状が出た時は、とりあえずパーキンソン病の治療薬を使ってみるなど、大変困っている状況です。
このPhase2aも実際には48週目、投与して1年後までのデータを見るのですが、すでに24週、投与から半年後の中間解析データをTransposon社より受け取っています。安全性上の問題、臨床試験の精度ともに、まったく問題ないという情報を得ています。ただし、Transposon社の意向によって、有効性に関しては、現段階ではみなさまにお伝えできない状況です。
臨床試験も進んでいるALS(筋萎縮性側索硬化症)、FTD(前頭側頭型認知症)や、お子さまが小さな頭で生まれてしまうAGS(アイカルディ・ゴーティエ症候群)などの病気に対しても「OBP-601」の開発が進められているため、安全性のみではなく、有効性も期待できる状況にあると私は推測しています。
このような状況で、今後は48週目のデータもおそらく組み入れが完了してフォローアップしていますので、2023年度末までにはデータがまとまるのではないかと推察しています。この2番目のALS、FTDなどの、別の疾患の臨床試験についても、24週目の中間解析データはおそらく年内に出てくるのではないかと期待しています。
今後に向けて
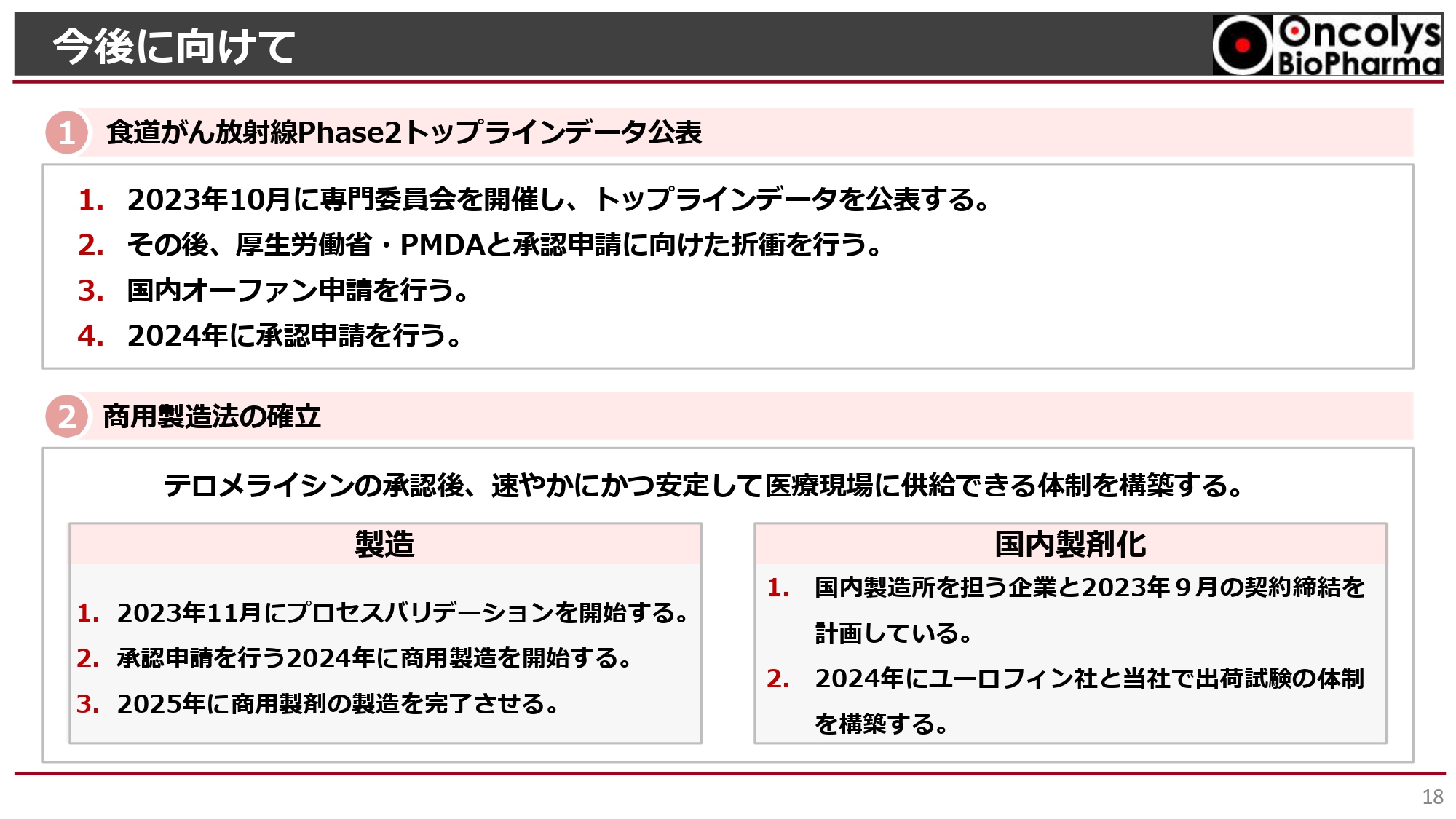
株主のみなさまにご期待いただきたい6つの状況をご説明してきました。最終的に今後どうするかについては、すでにお話しした分も多々ありますが、食道がんのトップラインデータについては10月に専門委員会を開いて、即座にみなさまに公表していきたいと考えています。
その後、このデータをもとに厚生労働省、PMDA、先駆けの審査がさらに加速されていくはずです。良いデータであれば、国内オーファン申請という希少疾患等としてステータスの申請も行います。製造もうまくいけば、2024年には予定どおり承認申請を行う段取りはまったく変わっていません。
商用製造についても、GMPがうまく通りましたので、11月にはプロセスバリデーション試験が始まり、その品質試験の結果が来年初頭に出てきます。それがうまくいくと商用製造に入りますので、国内ですぐに出荷試験ができるようにユーロフィン社、及び当社での体制を整備しています。
今後に向けて

いよいよ「テロメライシン」の商用化に向けて、最終段階にきている状況です。一方で、製造販売体制は国内の問題として、総括製造販売責任者を含む人をアサインする、そしてSOPと体制を整備する作業は残っていますが、これも粛々と進めていくことができると思います。
また、国内販売パートナーとの条件面については、すでに交渉を行っていますので、年内にはみなさまにご報告したいと考えています。アメリカの大手製薬企業との共同開発に対する構築についても、9月中にみなさまにご報告できるように努力していきたいと思っています。
「OBP-601」の難病治療薬についても、今後はどのように開示していくかという交渉をTransposon社としており、みなさまにもきちんとしたご報告ができるようにしていきたいと考えています。以上が本日の2023年12月期中間決算のご報告でした。
質疑応答:「テロメライシン」の承認申請時期の変更有無と、専門委員会の講義内容について
司会者:「組み入れが完了した『テロメライシン』の、承認申請時期の変更有無について教えてください。また、2023年6月に開催した専門委員会の講義内容について教えてください」というご質問です。
浦田:現段階では承認申請時期の後ろ倒しは計画していません。予定どおり承認申請していきたいと思っています。また、6月29日に行われた専門委員会については、基準となるデータをどのように持っていくかという問題、あるいは出てきたデータをどのようにまとめていくかを考えています。
例えば、食道がんの治験には高齢の方がたくさん入っており、治療した後に食道がんの再発で亡くなることはあまりないかもしれませんが、やはり高齢のため、心臓疾患や交通事故で亡くなる症例をどのように取り扱うかを、専門医の先生方と話し合っている状況です。
質疑応答:国内の「テロメライシン」の販売提携の状況と、契約締結まで時間を要している理由について
司会者:「国内の『テロメライシン』の販売提携の状況について教えてください。また、契約締結まで時間を要している理由についてご説明をお願いします」というご質問です。
浦田:当社は随分前から販売提携していきたいとお話ししています。上期くらいには締結したいと考え、すでに複数社と最終の詰めを行っているのですが、いくつか問題があります。1つはマーケットの問題です。食道がん、放射線単独、併用についてはオーファン申請を行うほど国内では希少疾患であり、患者さまが少ないからです。
また、薬価に関しての問題があります。第一三共が発売している「デリタクト」というヘルペス製剤の薬価は、一瓶143万円と公表されているのですが、この薬価に引きずられるのか、あるいは我々の努力によってもっと高薬価が取れるのか、このあたりがある程度クリアにならなければ、なかなか販売提携できないという話も出ています。
さらに、先ほどお話ししたとおり、どちらがどれだけ取るのかというパーセンテージの線引きです。このあたりも思ったより時間を有しており、みなさまに大変ご心配をおかけしているところですが、なんとか年内に合意形成し、提携先と一緒に事業を進めていきたいと考えています。
質疑応答:製造プロセスのバリデーションの進行状況とヘノジェン社の製造工程における改善点について
司会者:「製造プロセスのバリデーションの進行状況を教えてください。ヘノジェン社での製剤化までの工程で改善すべきポイントがありましたら、具体的に教えてください」というご質問です。
浦田:GMP製造はうまくいきましたが、いくつか改善点もあります。2023年11月からプロセスバリデーションを行うことは、すでに当社で決定しており、「プロセスバリデーションとして何に注意しなければならないのか」という最終的な話し合いを進めています。
その中で当社がヘノジェン社に改善を求めていることは、「実際に製造現場を担当する作業員や従業員の方々に対し、製造に関する教育をより深く行っていただきたい」ということです。これは人員に関する問題ですが、例えば「これまでGMP製造を行ってきた人にプロセスバリデーションにも携わってもらうことで、ナレッジと経験をどんどん積んでいただきたい」ということを要求しています。
基本的にSOPあるいは細かい操作手順のようなものの変更については少しずつ進めており、おそらく11月から始まるプロセスバリデーションには十分間に合うといった状況です。今月末には新たに1人を派遣し、現場でミーティングを行っていきたいと考えています。
質疑応答:「テロメライシン」の国内製造所の状況と、ヘノジェン社から出荷に至るまでのハードルについて
司会者:「現在交渉中の『テロメライシン』の国内製造所の状況について教えてください。また、ヘノジェン社での製造から医療現場までの一連のプロセスにおける『テロメライシン』の取り扱いに関するハードルについて教えてください」というご質問です。
浦田:こちらも、先ほどお話ししたとおりです。国内製造所をどこにするかということですが、ほぼ1社にしぼっています。製造所として、当社も「テロメライシン」を取り扱える場所があり、ヘノジェン社から送られてきたものは、瓶の状態で届きます。
一方で、国内でデリバリーを行う際には、商品を箱詰めして保管する必要があり、そのための場所を整えるには少し時間がかかります。また、国内製造所と提携し、契約を結んだ場合も、実際に製造所で箱詰めができるのか、安全に行えるのか、こぼしてしまう恐れがないのか、シールを適切に貼れるのかなど、バリデーションが必要です。
その後の製造所から実際に出荷されて、例えば提携会社、卸会社、医療機関にまで、安全かつ安定的に運ぶことができることを確認するためのバリデーション試験も必要です。このように、国内製造所と契約した後も、依然としてかなり厳格なバリデーションをしなければなりません。
質疑応答:ASCOで発表されたコーネル大学での胃がんの医師主導治験の内容と「テロメライシン」の適応拡大について

司会者:「今年の6月にASCOで発表されました、コーネル大学での胃がんの医師主導治験の内容について教えてください。また『テロメライシン』の適応拡大については、食道がんから胃がんへ拡大を目指す方向でしょうか?」というご質問です。
浦田:まず、適応拡大のご質問については、「食道がんから胃がんへ拡大する」ということではございません。現在、アメリカでは食道がんよりも胃がんの患者さまのほうが多く、すでにさまざまな良い結果が出ているため、胃がんの治験を進めていく方針です。日本で食道がんの臨床試験の承認を取ることと、アメリカで胃がんの治験を進めていくことは、別であるとお考えいただければと思います。
次に、ASCOのご質問については、この臨床試験を開始した頃は、1次治療として免疫チェックポイント阻害薬単独での使用が認められていましたが、現在は単独では認められなくなり、化学療法と併用されています。
このような背景から、ASCOで発表されたレジメンは今後使用できなくなるとはいえ、奏効が見られていたため、まだ確立されていない2次治療の空白を埋めていこうという戦略を当社の主眼としています。
質疑応答:海外製薬会社との共同開発体制の構築が遅れている理由について
司会者:「『テロメライシン』に関する質問として、上半期中に締結を目指していたアメリカの免疫チェックポイント阻害剤を保有する製薬会社との共同開発体制の構築について、交渉の状況と想定よりも時間を要している理由を教えてください」というご質問です。
浦田:上半期中に提携・締結したかったのですが、コーネル大学を挟んで、当社と大手製薬会社があり、コーネル大学の中での、例えば経費の計算などにかなり時間がかかっています。当社がこの中に入っていくことは難しい状況であり、予想以上に時間がかかっていますが、最終的には9月末までに締結できるだろうと見込んでいます。体制の構築が遅れたことに関しては、大変申し訳ないと考えています。
質疑応答:「OBP-601」の中間解析結果に関するTransposon社からの非開示要請について

司会者:「『OBP-601』のPSPに関する中間解析の結果を受領したそうですが、Transposon社の非開示要請について、どのように解釈すれば良いでしょうか?」というご質問です。
浦田:これには多くの複雑な状況が加味されていますが、Transposon社が非常に気にかけていることの1つに、世の中に「OBP-601」と同種同効の「逆転写酵素阻害剤」がたくさんあり、そのすべてがジェネリックになっているというものです。
「逆転写酵素阻害剤」を販売しているジェネリックメーカー、大手製薬企業、HIVのフランチャイズ企業では、PSPやALSに効くかどうかもわからない状況にあまり気がついていない上に、臨床試験も十分に行われていません。
このような状況でTransposon社が効果のある領域、安全性、臨床試験のプロトコルなどに関する発表をすると、類似の企業がどんどん参入し、競争が激化する可能性があることを非常に気にかけているようです。初期の結果が確実なものとして捉えられるまでは詳細な発表を控えてほしいということが、Transposon社の真意であると考えています。
質疑応答:「OBP-601」の臨床試験の進捗状況について
司会者:「『OBP-601』に関して、7月から新たにAGS患者さまへの投与が開始されました。3つの臨床試験が順次進展している状況をどのように解釈すれば良いでしょうか?」というご質問です。
浦田:さまざまな解釈があると思いますが、仮に、PSPに対してまったく効果が見られなかった、副作用が酷かったということがあれば、リスクを冒してまで、他の疾患への投与には広げていかないだろうと私は思います。したがって、AGS患者さまにも投与が開始されたということは、なんらかの手応えがあったのではないかと個人的に考えています。
AGSは他の疾患とはまったく異なる上に、特に子どもに多い神経難病です。錠剤よりもドライシロップや飲み込みやすい製剤で治療しているため、新しい世代への応用も含めて検討しています。そのような意味では、あまり悲観的な結果にはなっていないのではないかと考えています。
質疑応答:資金繰りや決算数値の見通しについて
司会者:「資金繰りや決算数値の見通しについて教えてください。2023年7月から資金調達を開始されていますが、今後想定されうる『テロメライシン』の国内販売提携契約による収入や、Transposon社からのマイルストーン収入と合わせることで、『テロメライシン』の上市までの資金は確保できたという理解でよろしいでしょうか?」というご質問です。
吉村:確保できたかについては、今後の資金調達及び販売提携先との経済条件がどのようになるか次第ですが、今回の資金調達をもって、進めていきたいと思っています。
質疑応答:昨年と比較した場合の研究開発費の水準について
司会者:「研究開発費の見通しについて教えてください。2022年の研究開発費は、「テロメライシン」の国内でのPhase2治験の組み入れもあり、組み入れ完了前に約9億4,000万円となっていました。今後、承認審査を行う予定である2024年の研究開発費は、昨年の金額と比較してどのような水準で着地する見通しでしょうか?」というご質問です。
吉村:具体的な金額は申し上げられませんが、先ほどのご説明のとおり、当社はヘノジェン社に対し、製造開発のための多額の前払金を支払っています。その前払金が、開発の進展に伴い費用化されることが今期の下半期及び来期の上半期に生じる予定であり、ある程度の費用発生が見込まれます。
なおかつ、大手製薬企業との海外での共同開発提携により、一定の開発経費を負担しなければならないため、それに伴った経費も発生すると考えています。ただし、来年には商用製造が開始されます。ここにも当然支払いが発生しますが、商用製造が成功した場合は会社の資産として将来の製品になるため、研究開発費としては計上されません。
したがって、開発費用の総額については、昨年に比べて減少すると考えています。
質疑応答:腫瘍溶解性ウイルス全体および「テロメライシン」の利用拡大に関する課題について
司会者:腫瘍溶解性ウイルス全体に関して教えてください。腫瘍溶解性ウイルスでは、ヘルペスウイルスとして、アムジェン社の『T-VEC』や第一三共の『デリタクト』などがすでに上市されていますが、売上拡大に苦戦をしているように見受けられます。各腫瘍溶解ウイルス固有の問題があるのだと思いますが、『テロメライシン』はそのハードルを越えられそうでしょうか?
浦田:アメリカにあるアムジェン社の「T-VEC」は、国内市場には入ってきていません。しかしアメリカ内で「T-VEC」が許可を取った「メラノーマ」という疾患には、すでにたくさんの抗がん剤が出てきたことから競争が激しくなり、苦戦している状況にあると考えられます。
国内には第一三共の「デリタクト」が存在しますが、この薬には規制当局からさまざまな条件がつけられていて、実際に臨床試験を行った施設以外では使用することができないようです。「デリタクト」自体が非常に小規模な施設で治験を行ったため、どの施設でも使用できる薬にはならなかったために、大変苦戦していると聞いています。
一方で、当社は先ほどお話ししたとおり、国内17箇所の施設で臨床試験を行っています。仮に条件が限定された場合でも、17箇所の施設で使用することができる上に、実際に規制されることはないだろうと考えています。
また、当社は、できる限り幅広い施設で「テロメライシン」が使用できるようにするために、食道学会あるいは内視鏡学会などの学会で、この治療薬が今後どのように使われていくか、市販後の研究開発においてどのような使い方ができるかなど、追加の臨床試験とはならないまでも、さまざまな議論を進めています。
例えば、遺伝子組み換えされたウイルスの拡散を防ぐため、カルタヘナ法による規制もかけられてきました。その中で当社はさまざまなデータを収集し、そのような規制を非常に軽微にすることができるマニュアル作りにも、すでに着手しています。この取り組みがうまくいけば、かなり幅広い施設で「テロメライシン」の利用が実現できるのではないかと期待しています。
浦田氏からのご挨拶
浦田:「テロメライシン」は開発最終段階になっており、いよいよ来年には承認申請ができる見通しです。現在、社員が一丸となって「テロメライシン」の承認申請に向けて日々努力を重ねています。今後もみなさまのご支援とご鞭撻を賜りたいと考えています。本日はどうもありがとうございました。
この銘柄の最新ニュース
オンコリスのニュース一覧- 【↑】日経平均 大引け| 4日ぶり反発、自律反発狙いの買いが優勢 (3月5日) 今日 16:16
- <動意株・5日>(大引け)=リバーエレク、JDSC、オーバルなど 今日 15:36
- 東証グロース(大引け)=値上がり優勢、Gモンスター、JDSCがS高 今日 15:33
- <動意株・5日>(前引け)=マイクロ波、オンコリス、バイセル 今日 11:33
- 東証グロース(前引け)=値上がり優勢、Gモンスター、メドレックスがS高 今日 11:33
マーケットニュース
おすすめ条件でスクリーニングされた銘柄を見る
オンコリスバイオファーマの取引履歴を振り返りませんか?
オンコリスバイオファーマの株を取引したことがありますか?みんかぶアセットプランナーに取引口座を連携すると売買履歴をチャート上にプロットし、自分の取引を視覚的に確認することができます。
アセットプランナーの取引履歴機能とは
※アセプラを初めてご利用の場合は会員登録からお手続き下さい。



