クリングルファーマのニュース
クリングルファーマ、脊髄損傷急性期第Ⅲ相試験でHGFの有効性を検証、製造販売承認申請に向け着々と準備
アジェンダ

安達喜一氏:みなさま、こんにちは。クリングルファーマ株式会社代表取締役社長の安達喜一です。本日は当社の第1パイプラインである脊髄損傷急性期第Ⅲ相試験のトップラインデータ及び2024年9月期第1四半期の決算についてご説明します。
本日のアジェンダです。はじめに会社概要として、当社の特徴、開発パイプラインの概要、今後の成長戦略について、続いて、脊髄損傷急性期第Ⅲ相試験のトップラインデータとして、HGFの作用機序、第Ⅰ/Ⅱ相試験の結果、第Ⅲ相試験のトップラインデータについてご説明します。
最後に、2024年9月期第1四半期決算概況について、2024年9月期第1四半期のトピックス、経営成績の概況、財政状態の概況をお話しします。
会社概要

当社は2001年12月に大阪大学・慶應義塾大学発創薬バイオベンチャーとして設立されました。企業理念は「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」です。現在、私たちは再生創薬シーズであるHGFの医薬品開発に注力しています。
当社の特徴

当社の特徴は大きく2つあります。1つ目の特徴は、レイトステージのパイプラインを複数有する再生創薬バイオベンチャーであることです。当社は希少疾患を対象に自社開発を推進することを基本方針とし、現在すでに第Ⅲ相試験のパイプラインとして、脊髄損傷急性期と声帯瘢痕の2つのパイプラインを有しています。
また、第Ⅱ相試験にALS、第Ⅰ相試験に急性腎障害と、合計4つの臨床段階のパイプラインを有しています。
2つ目の特徴は、組換えHGFタンパク質の製造でプラットフォームを有する、再生治療薬のプラットフォーマーであることです。組換えHGFタンパク質は、ファースト・イン・クラスの開発シーズですが、これを医薬品のグレードで製造し、量産する体制を確立しているのは世界中でも当社のみです。
製造したHGFタンパク質を使い、多くの疾患への適用拡大によって今後の成長を遂げていきたいと考えています。
すでに米国のクラリス・バイオセラピューティクス社(以下、クラリス社)に製造したHGF原薬を供給しており、クラリス社が米国とカナダで神経栄養性角膜炎を対象に第Ⅰ/Ⅱ相試験を実施しています。
また、当社が開発している脊髄損傷急性期から慢性期への拡大、あるいは声帯瘢痕から他の線維化疾患への拡大などの適応拡大によって、今後の成長を遂げていきたいと考えています。
HGF(肝細胞増殖因子) ~難治性疾患の再生治療薬~
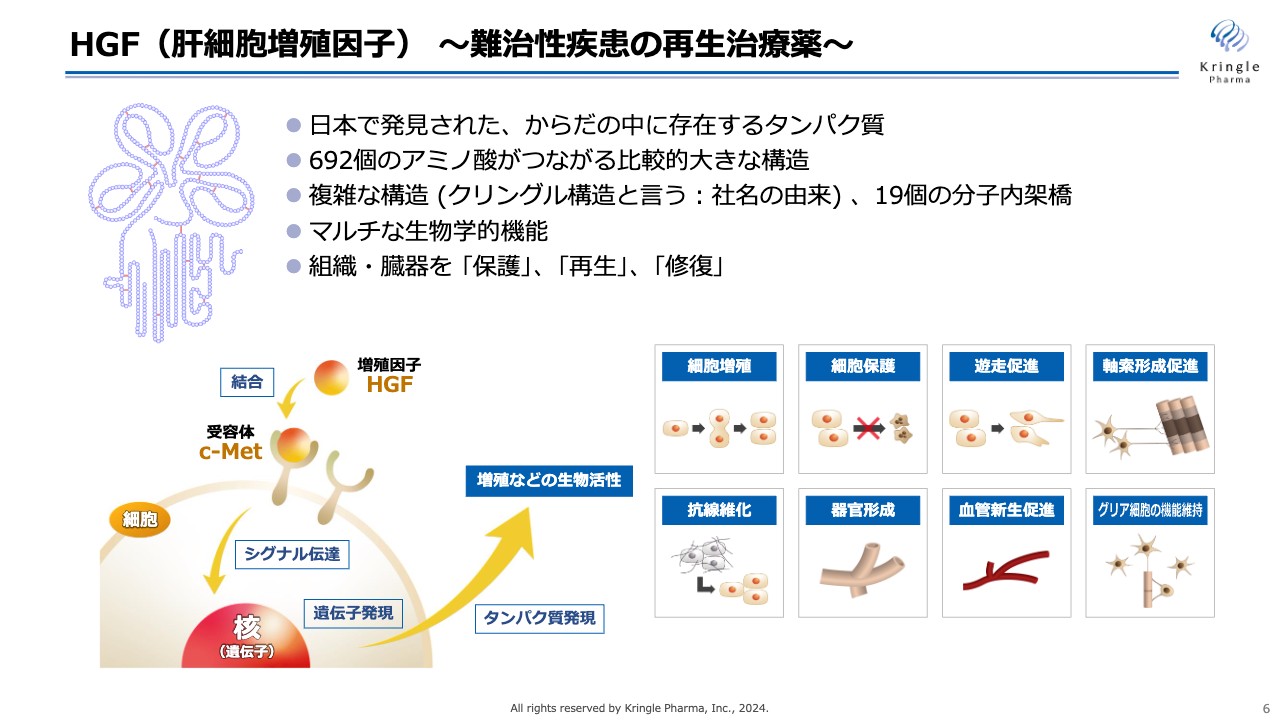
当社が開発しているHGFについてです。HGFは日本語で「肝細胞増殖因子」という名前がついており、もともと日本で発見された体内に存在するタンパク質のことを指します。
スライド左側に2次構造を示していますが、692個のアミノ酸がつながった非常に大きなタンパク質で、複雑な構造を持っています。分子内に19個の分子内架橋があり、これによって複雑な構造を維持しています。
上部にある四つ葉のクローバーのような形は「クリングル構造」という名前がついており、当社の社名の由来にもなっています。HGFの特徴としては、細胞を増殖させるだけではなく、マルチな生物学的機能を有することが挙げられます。
HGFは、体内で細胞膜にある受容体「c-Met」と結合します。そこからシグナルが核に伝わり、遺伝子発現を経てタンパク質が発現していきます。機能としては細胞を増殖させるだけではなく、細胞保護、遊走促進、抗線維化、器官形成、血管新生促進、中枢神経系では軸索形成促進やグリア細胞の機能維持に関与しています。
このように1つの分子でマルチな生物学的機能を持つHGFですが、対象とする臓器も肝臓だけではなく体中のさまざまな組織・臓器の保護、再生、修復を担うことがわかっています。
HGF再生治療薬のプラットフォーマー: HGFタンパク質の量産体制
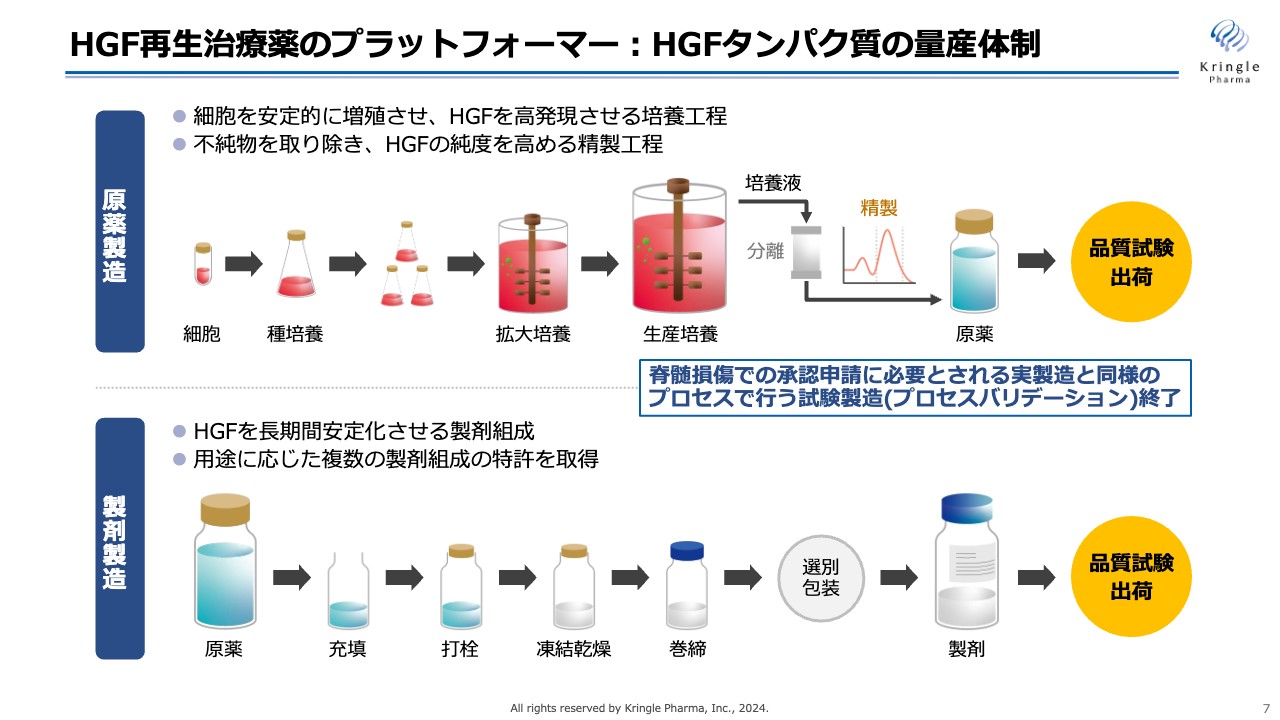
当社のプラットフォームであるHGFタンパク質の製造についてです。大きく原薬製造と製剤製造の2つに分かれます。
HGFタンパク質は、いわゆるバイオ医薬品です。化学合成ではなく、細胞を大量に培養し、その細胞にHGFを作らせて、最終的に培養液からHGFを生成するという工程で作られます。スライドには単純化して記載していますが、非常に複雑な工程を経てHGFタンパク質の原薬を製造します。
その後、HGF原薬をガラスバイアルに充填して凍結乾燥することで、長期間安定な製剤を製造します。
当社は原薬製造・製剤製造の両方で医薬品グレードの製造体制を整えており、脊髄損傷での承認申請に必要とされる実製造と同様のプロセスで行う試験製造(プロセスバリデーション)をすでに終了しています。
開発パイプラインの概要
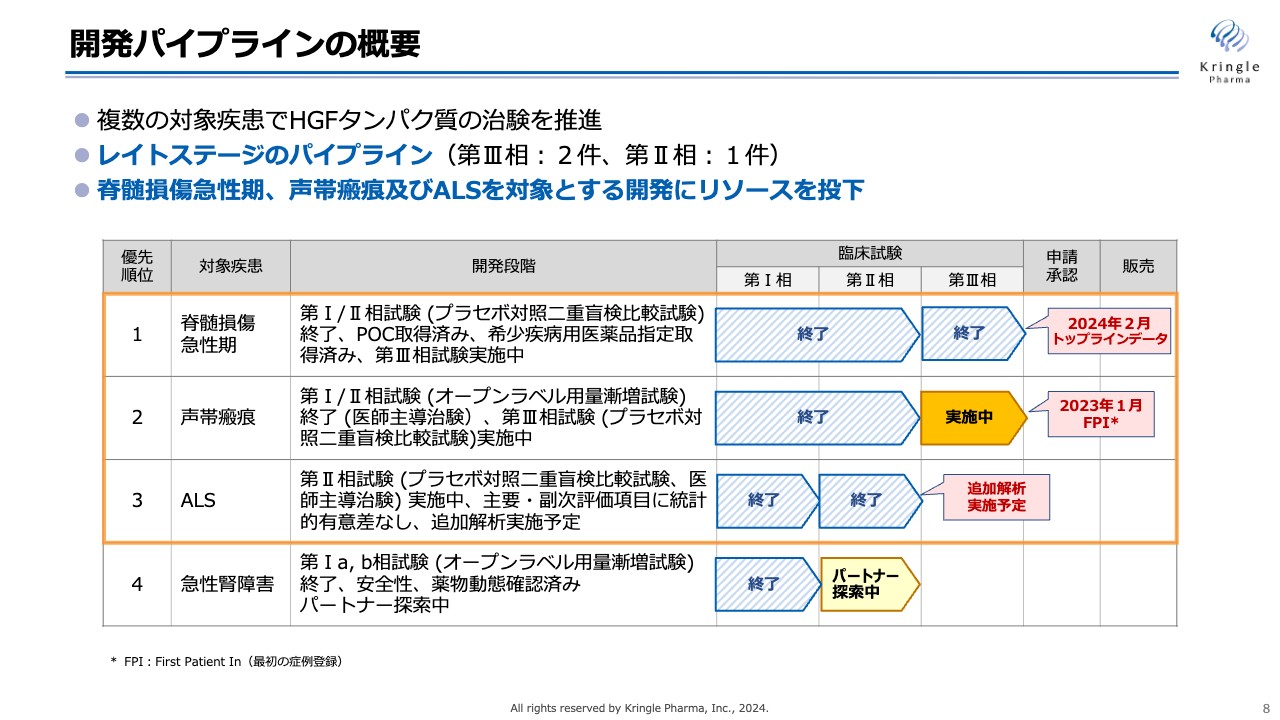
当社の開発パイプラインです。複数の対象疾患でHGFタンパク質の治験を推進しています。第1パイプラインの脊髄損傷急性期については、すでに第Ⅰ/Ⅱ相試験を終了し、第Ⅲ相試験を2023年末に終了しました。後ほど、トップラインデータとして第Ⅲ相試験の結果をご説明します。
第2パイプラインの声帯瘢痕は、第Ⅰ/Ⅱ相試験を国内で終了しており、第Ⅲ相試験を実施中です。第Ⅲ相試験は2023年1月に最初の患者の登録が終了しており、現在国内の5つの施設で患者の組入れを継続しています。
第3パイプラインのALSについては、第Ⅱ相試験を医師主導治験として終了し、現在追加解析を行うべく、東北大学との協議を継続しています。
第4パイプラインの急性腎障害については米国で第Ⅰ相試験が終了しており、現在第Ⅱ相試験のためのパートナーを探索中です。
クリングルファーマの成長戦略
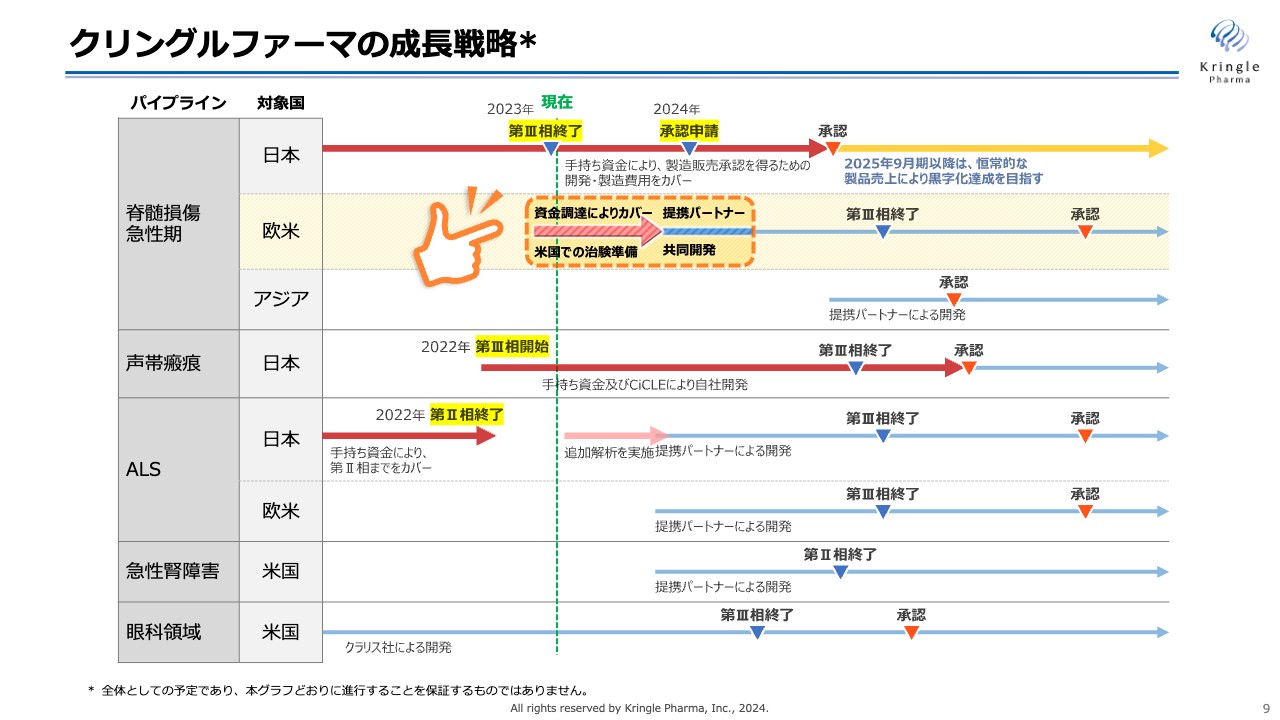
当社の成長戦略です。第1パイプラインである脊髄損傷急性期について、国内の開発は2023年に第Ⅲ相試験を終了し、2024年は承認申請のための準備を進めていきます。
2025年9月期に薬事承認を取得し、その後、恒常的な製品売上によって黒字化の達成を目指すことが一番大きな目標です。脊髄損傷急性期の国内の開発については、現在の手持ち資金により、製造販売承認を得るための開発・製造費用をすでに確保しています。
今後は、脊髄損傷急性期のパイプラインを米国で開発するため、治験の準備をスタートしました。2023年に資金調達を発表しており、資金調達を実施中です。米国の治験準備を経て、共同開発の提携パートナーを得て、その先の開発を進める方針です。
第2パイプラインの声帯瘢痕については、すでに第Ⅲ相試験を開始しており、手持ちの資金や公的資金を活用し、第Ⅲ相試験終了、承認申請、承認取得まで自社で開発を行っていきます。
第3パイプラインのALSについては第Ⅱ相試験が終了しており、今期中に追加解析を行い、この結果をもって、その後の開発を進める提携パートナーを得る方針です。
第4パイプラインの急性腎障害については、提携パートナーを経て第Ⅱ相試験に入っていきます。
第5パイプラインの眼科領域についてはクラリス社とすでに提携しており、クラリス社が米国で開発を進めています。
患者数と市場規模

患者数と市場規模です。当社が開発している脊髄損傷急性期、ALS、声帯瘢痕ともに希少疾患であるため、日本での患者数はそれぞれ6,000人、1万人、1万2,000人と限定的です。ただし、グローバルで見るとその約10倍の患者が存在します。
市場規模について、国内のみでは限定的ですが、早期に海外まで進めていくかが今後の当社の課題になると考えています。
今後の成長戦略と資金調達の位置づけ
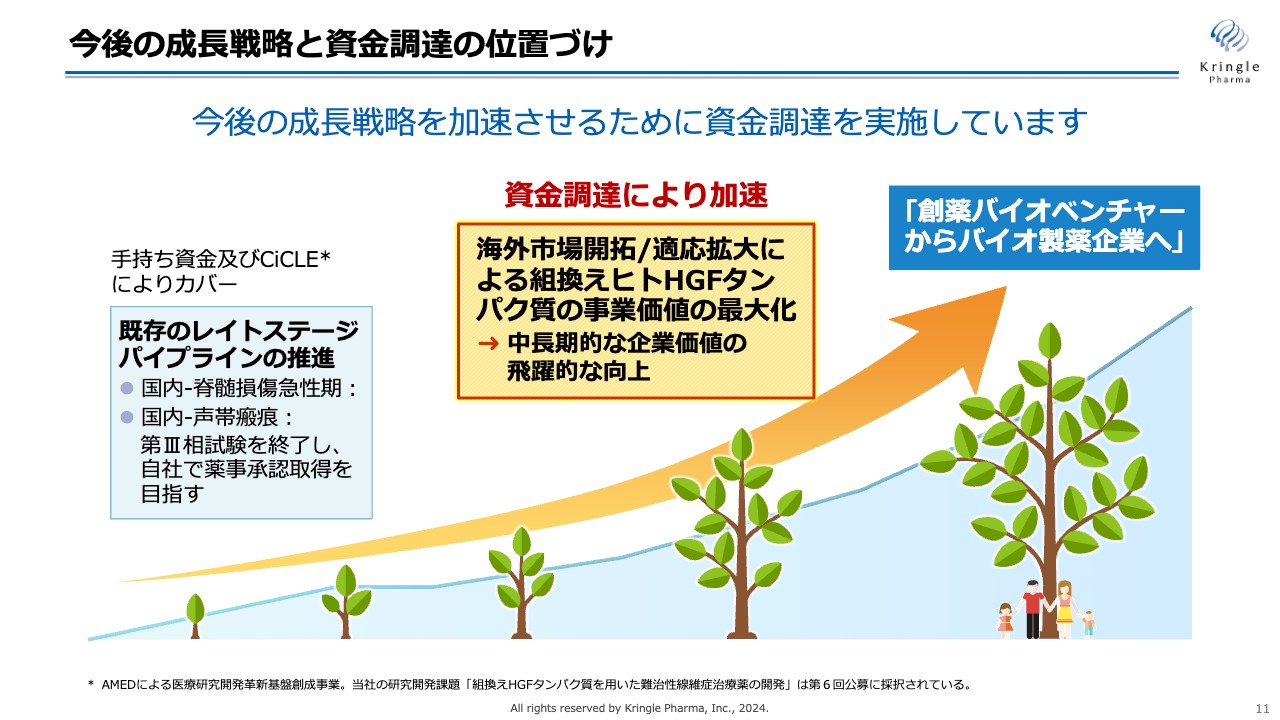
今後の成長戦略です。私たちは「創薬バイオベンチャーからバイオ製薬企業へ」と掲げ、成長を目指していきます。国内のパイプラインである脊髄損傷急性期はすでに第Ⅲ相試験を終了し、声帯瘢痕については第Ⅲ相試験実施中であり、今後自社で薬事承認を取得するまでの資金を確保しています。
今後は、早期に海外に展開し、いかに適応拡大を図っていくかがHGFタンパク質の事業価値の最大化、ひいては当社の中長期的な企業価値の向上につながると考えています。
現在、成長戦略を加速させるために資金調達を実施中です。その資金を活用し取り組んでいきます。
海外市場開拓:脊髄損傷急性期を対象とする米国での臨床開発 (資金使途①)
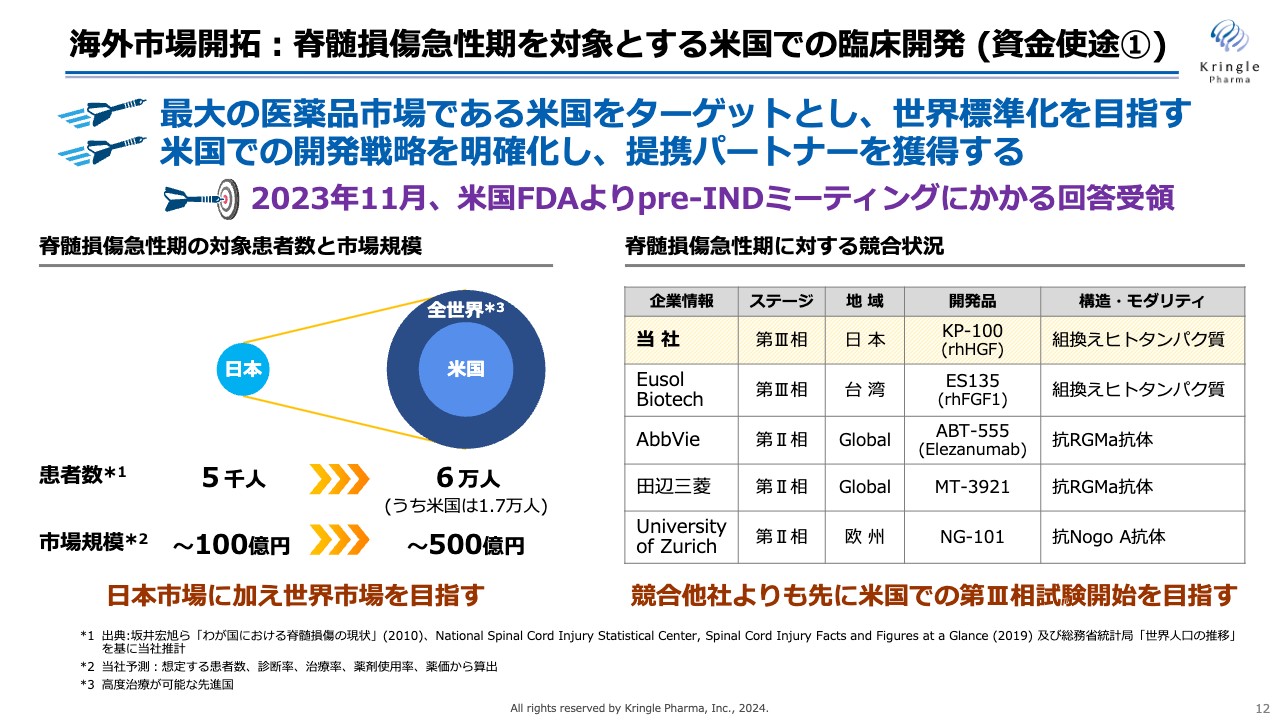
具体的には、脊髄損傷急性期を対象に米国での臨床開発に着手しました。米国は世界でも最大の医薬品市場であり、米国で承認を得ることにより世界標準になると考えています。
当社は、2023年11月に米国FDAとpre-INDミーティングを行い、FDAから回答を受領しています。これにより米国での開発戦略が明確化できたため、この情報をもとに、今後は事業開発をさらに活性化し、提携パートナーを獲得したいと考えています。
スライド右側には脊髄損傷急性期に対する競合状況をまとめており、当社はすでに第Ⅲ相試験に入っています。現在の開発テリトリーは日本に限定されているため、米国でも展開し、競合他社よりも先に米国で第Ⅲ相試験を開始するのが目標です。
海外市場開拓: HGFタンパク質の全世界での安定供給に向けて (資金使途①)
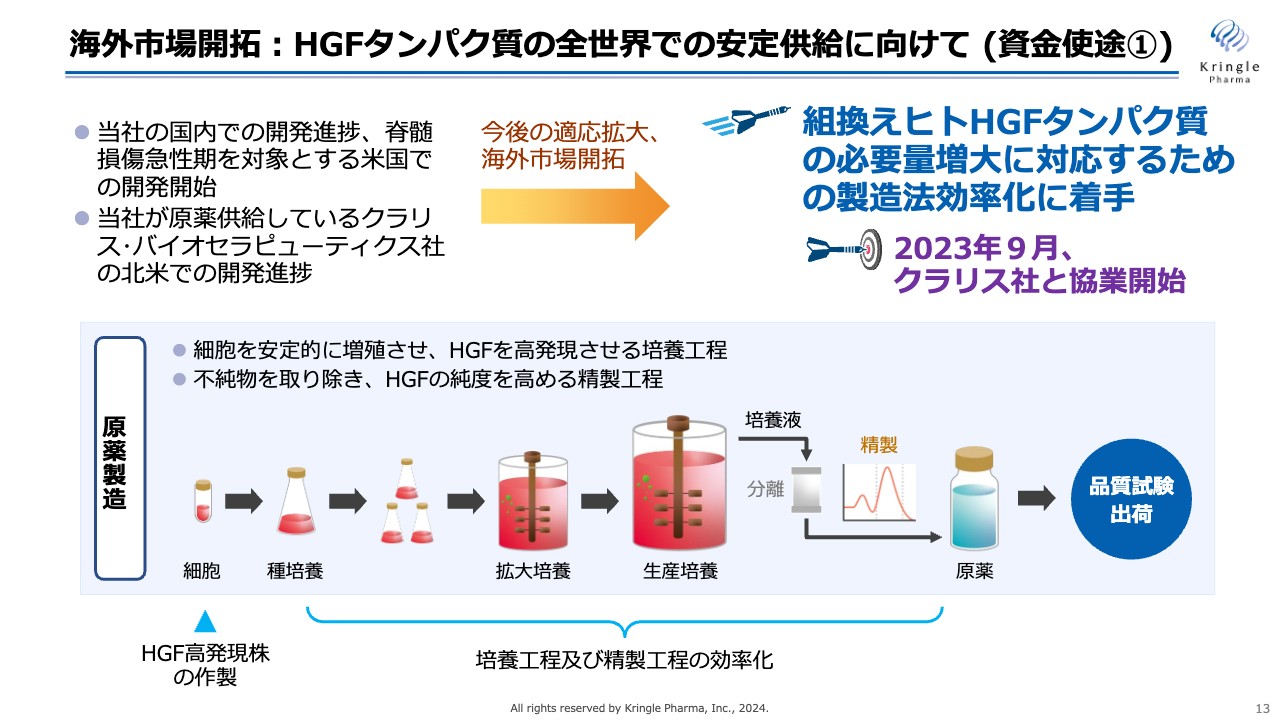
今後、開発パイプラインの進捗に合わせて、HGFタンパク質の供給量が増えていきます。これについては米国クラリス社とすでに協業を開始しており、より多くのHGFタンパク質を医薬品グレードで作る製造法効率化に着手しています。
適応拡大:新規パイプラインの創製 (資金使途②)
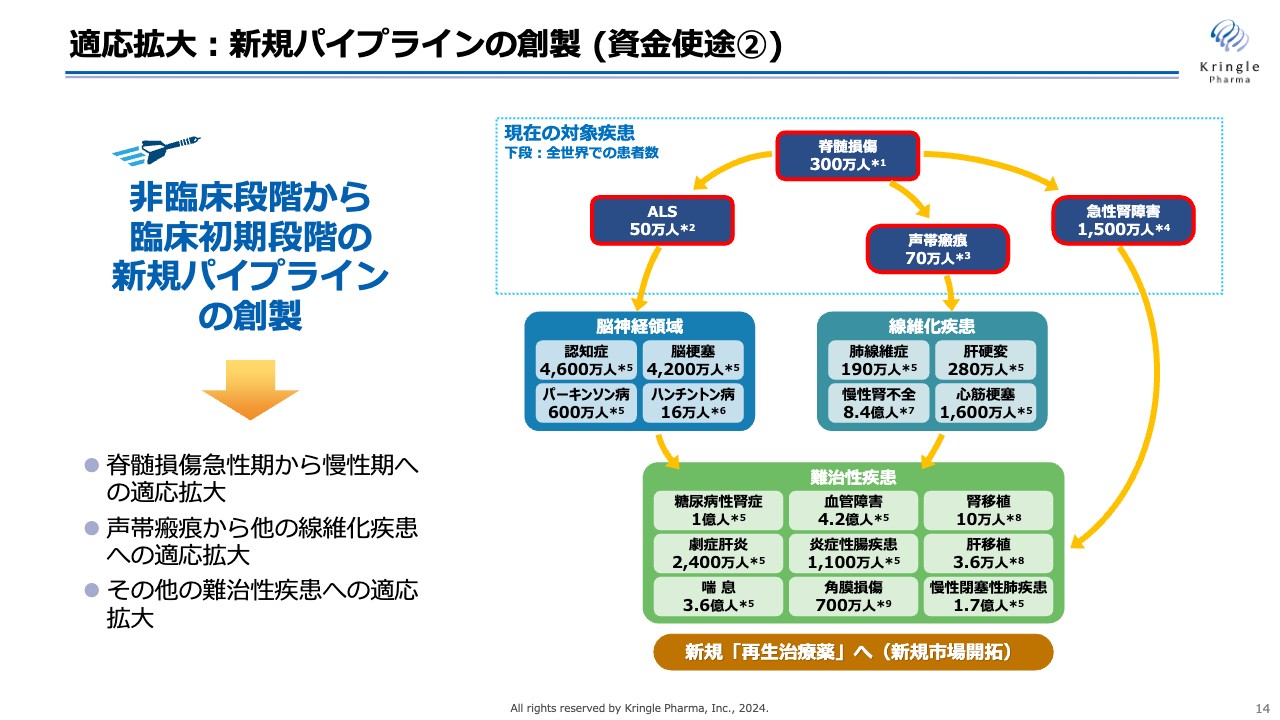
適応拡大についてです。HGFについてはすでに多くの研究がされており、さまざまな難病に対して動物モデルで効果があることが報告されています。
現在の対象疾患をスライド右側に記載していますが、当社が開発している脊髄損傷、ALS、声帯瘢痕、急性腎障害だけでなく、その他の脳神経疾患、あるいは線維化疾患、難治性疾患などにいかに早く展開していくかが、今後の当社の成長戦略に重要になっていきます。
したがって、現在行っている資金調達によって、今後、非臨床段階から臨床初期段階への新たなパイプラインを創製していきたいと考えています。
収益イメージ図
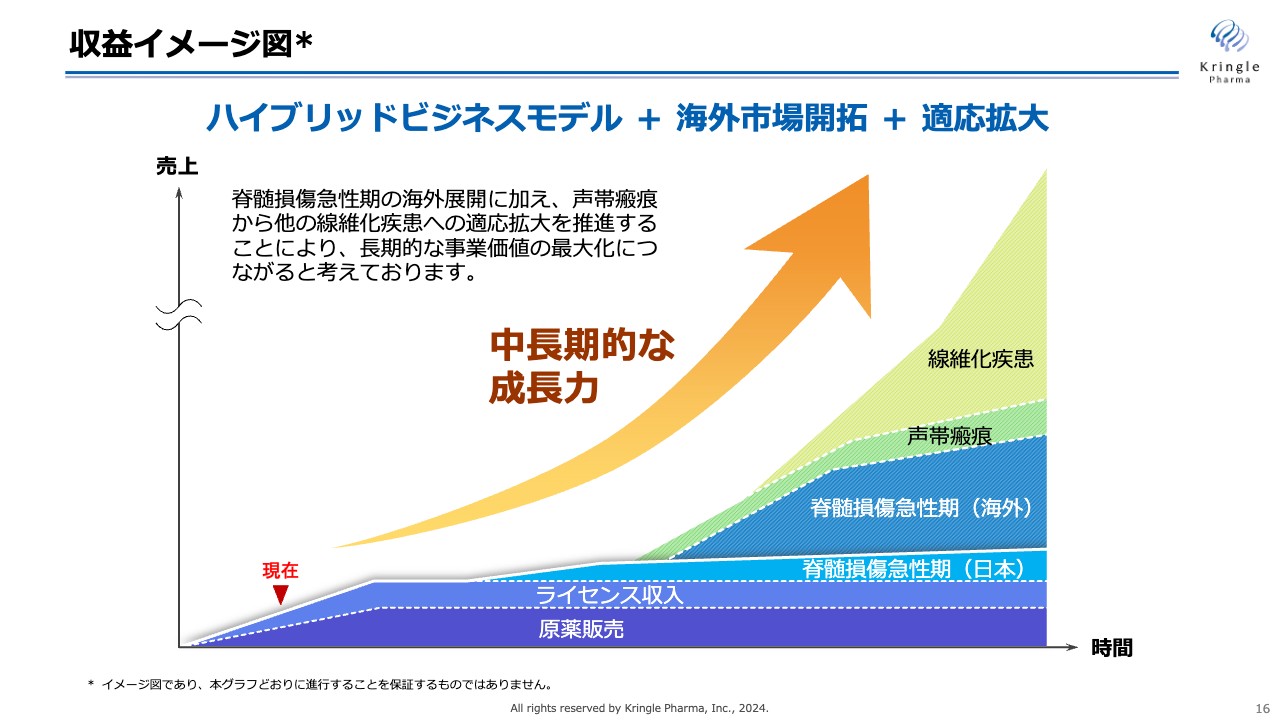
収益イメージ図です。原薬販売、あるいはライセンス収入で安定的な収益を維持しつつ、国内外での脊髄損傷急性期の承認取得、製品販売、さらに声帯瘢痕や線維化疾患への展開による収益によって、中長期的な飛躍的成長を遂げていきます。
開発パイプライン:脊髄損傷急性期

脊髄損傷急性期第Ⅲ相試験のトップラインデータについてご説明します。現在、日本では年間約6,000人の方がさまざまな原因によって脊髄損傷になると言われています。脊髄損傷では運動神経・感覚神経が傷害を受け、損傷部位が脳に近いほど広範な麻痺が残ります。
現在、急性期に対する有効な治療薬はなく、患者はもちろん、ご家族や介護される方の負担が非常に大きくなっています。医療経済効果の大きな疾患で、アンメットニーズも非常に高いものとなっています。
当社はこれまで、慶應義塾大学および大阪大学と共同研究を行い、脊髄損傷のモデル動物でHGFの薬効を確認しています。さまざまな公的資金を活用し、脊髄損傷急性期に対する第Ⅰ/Ⅱ相試験、そして今回、第Ⅲ相試験を終了するに至りました。
脊髄損傷急性期にHGFに期待する治療効果

脊髄損傷急性期にHGFに期待する治療効果をイラストで示しています。脊髄損傷では、最初に受けた損傷を「一次損傷」と言いますが、急性期には、この一次損傷が周りの組織細胞にどんどん広がっていく「二次損傷」と呼ばれる現象が起こります。
慢性期になると、最終的に広がった損傷範囲が瘢痕化、空洞化し、上から下への神経伝達が行われず、運動機能が低下します。
一方でHGFには、細胞死を抑え、細胞を保護する働きや、炎症反応を抑えるなどのマルチな働きがあるため、これを急性期に投与することによって、二次損傷の拡大をできるだけ抑える効果が期待できます。損傷範囲の拡大を抑えることができれば、患者の予後が改善し、運動機能が回復することも期待されます。
脊髄損傷急性期 第I/II相試験の結果
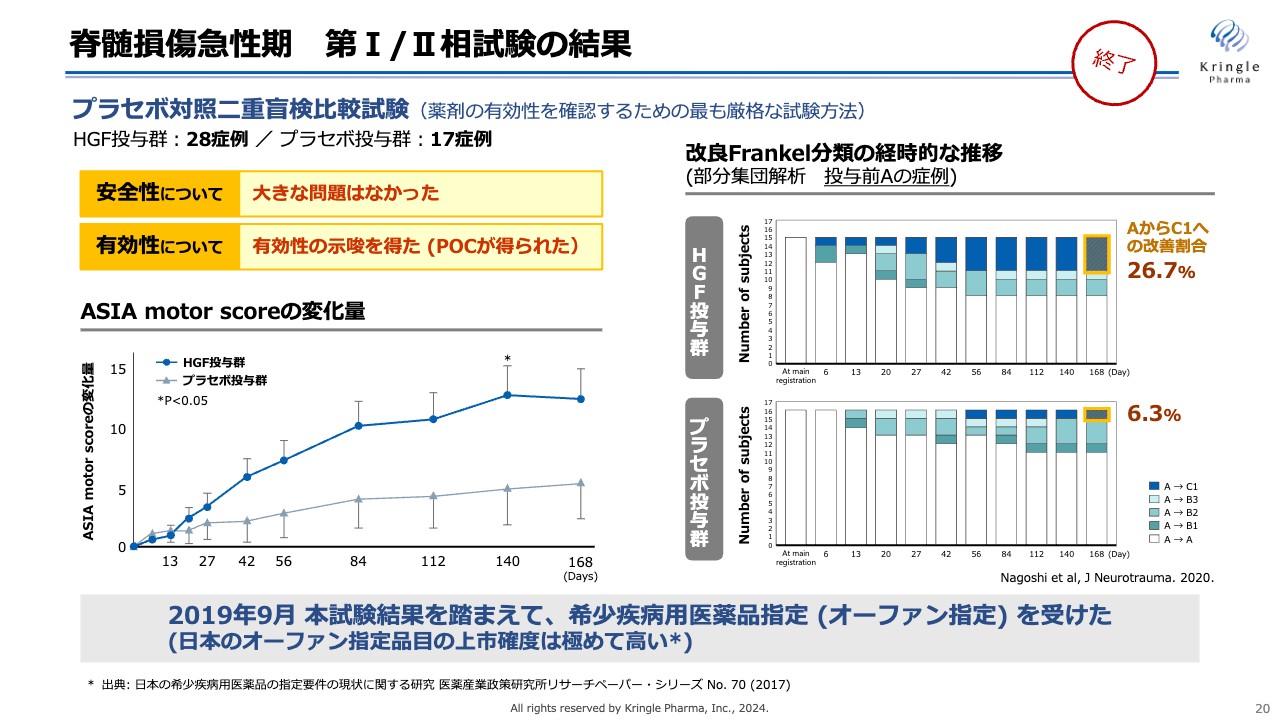
脊髄損傷急性期について、当社はすでに第Ⅰ/Ⅱ相試験を終了しています。この試験はプラセボ対照二重盲検比較試験として、HGF投与群28例、プラセボ投与群17例を比較したものです。安全性については大きな問題はなく、有効性を示唆する結果が得られました。
スライド左側のグラフは、全身の運動機能評価する「ASIA motor score」の変化量です。HGF投与群が濃い青色、プラセボ投与群が灰色で、横軸が6ヶ月にわたる経過観察期間を表しています。
ご覧のとおり、HGF投与群は6ヶ月にわたり高いスコアを獲得していることが確認できました。Day140では統計的な有意差も得られています。
この試験では、改良Frankel分類のA、B1、B2の患者をリクルートしており、右側のグラフは、投与前に重症度がAである症例に限った部分集団解析です。重症度Aとは完全麻痺であり、運動機能や感覚機能がまったくない、脊髄損傷の中でも最も重度な患者です。
上部のグラフのHGF投与群は、6ヶ月の経過観察期間にわたって、重症度がAからB、あるいはAからCに改善した方を示しています。濃い青色部分がAからC1へ2段階改善が見られた方です。
下部のグラフのプラセボ投与群では、AからC1へ2段階の改善が得られた方が6.3パーセントだったのに対し、HGF投与群では26.7パーセントと、大きな改善を確認することができました。これらの試験結果を踏まえ、2019年9月に希少疾病用医薬品指定(オーファン指定)を受けることができました。
日本のオーファン指定品目の上市確度は高い
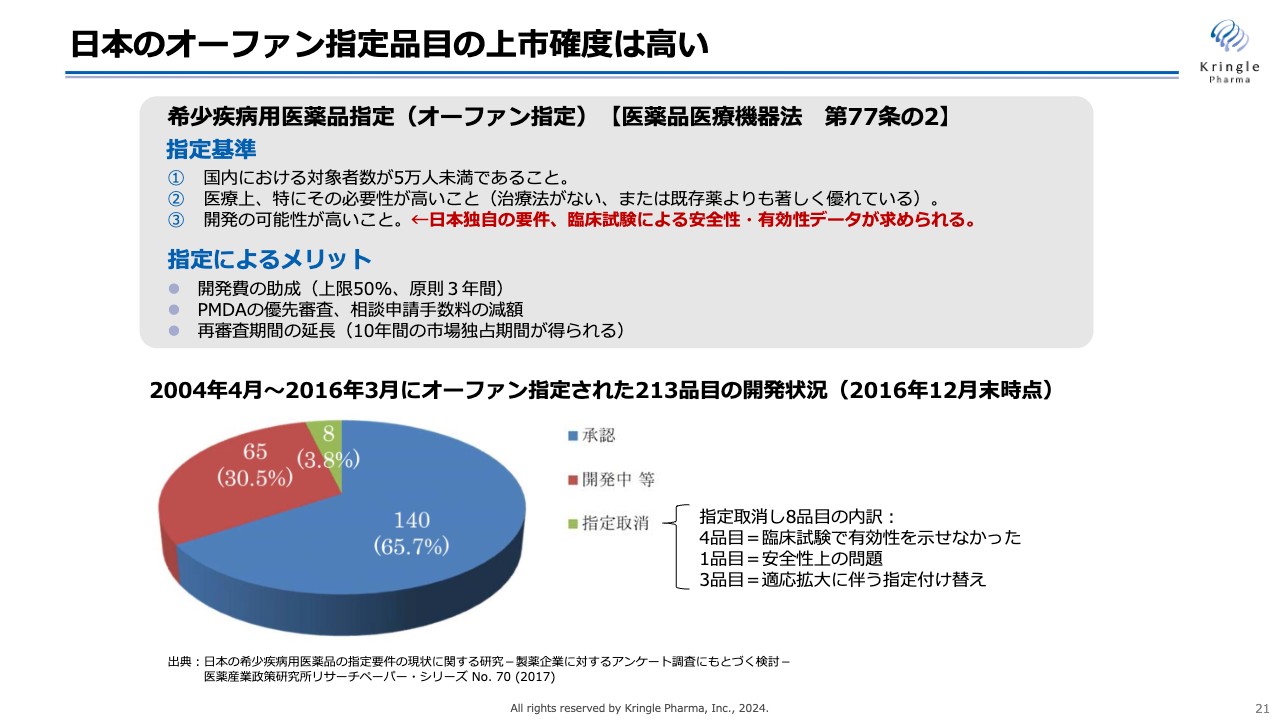
過去のデータより、日本でオーファン指定を受けると、その後の上市確度が非常に高くなることが示されています。日本のオーファン指定を受けるには3つの基準がありますが、3つ目の基準である「開発の可能性が高いこと」は日本独自の要件であり、臨床試験による安全性・有効性のデータが求められます。
当社の品目は、厚労省が第Ⅰ/Ⅱ相試験結果を確認し、オーファン指定を受けることができたため、今後、上市確度が非常に高くなると考えています。
脊髄損傷急性期 第III相試験(医薬品開発の最終段階)
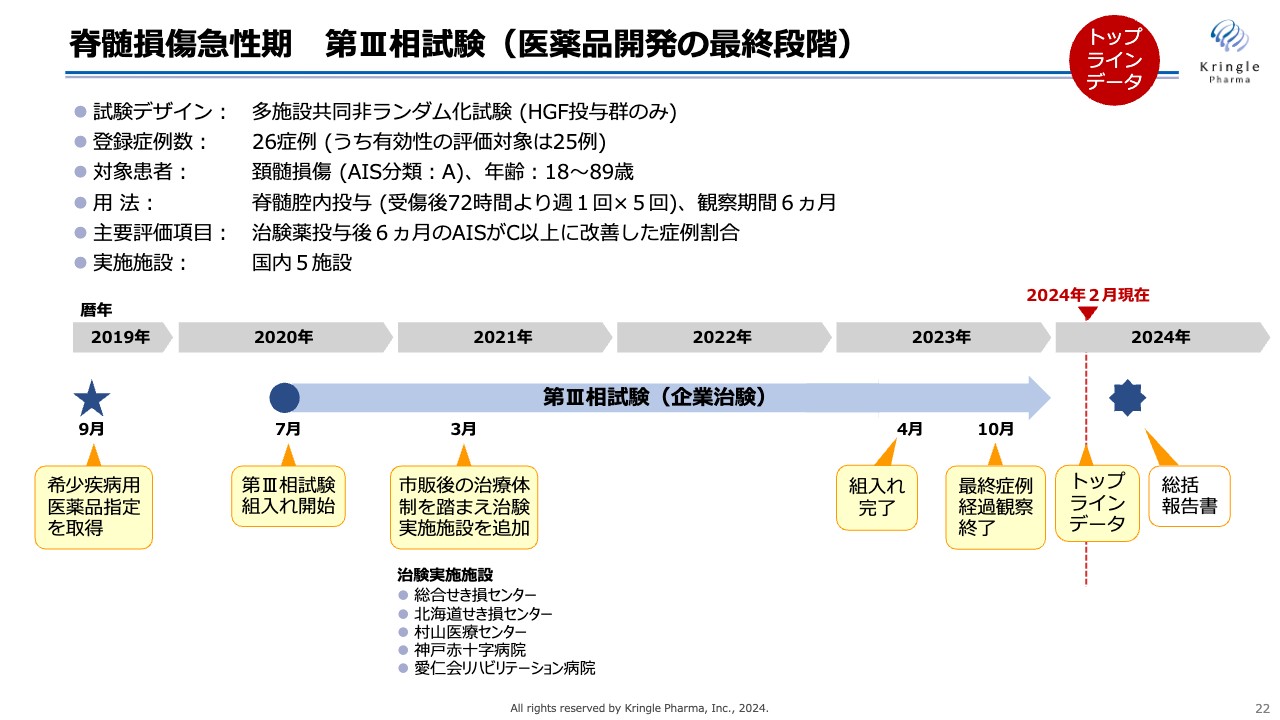
今回終了した脊髄損傷急性期第Ⅲ相試験の概要です。試験デザインとしては、多施設共同非ランダム化試験で、HGFを投与する群のみからなる試験です。登録症例数は最終的に26症例を登録し、うち有効性の評価対象は25例でした。
対象とする患者は、頚髄損傷の重症度分類(AIS)Aの方で、改良Frankel分類と同じく、運動機能や感覚機能の完全麻痺の患者です。
用量および用法は前相と同じで、受傷後72時間に脊髄腔内にHGFタンパク質を投与し、その後、週1回の投与を5回繰り返します。観察期間6ヶ月まで通常のリハビリを受けていただきながら、運動機能の回復をモニターしました。
本試験の主要評価項目は、治験薬投与後6ヶ月でAIS C以上に改善した症例割合としました。この試験は2020年7月に患者の組入れをスタートしましたが、コロナ禍真っ只中で行われたため、当初の想定よりも患者の組入れに時間がかかり、非常に苦労しました。
国内5施設で治験を行い、最終的に2023年4月に組入れを完了し、10月にLast Patient Out、つまり最終症例経過観察まで終え、今般トップラインデータを入手しました。
脊髄損傷急性期 第III相試験 -重症度の改善-
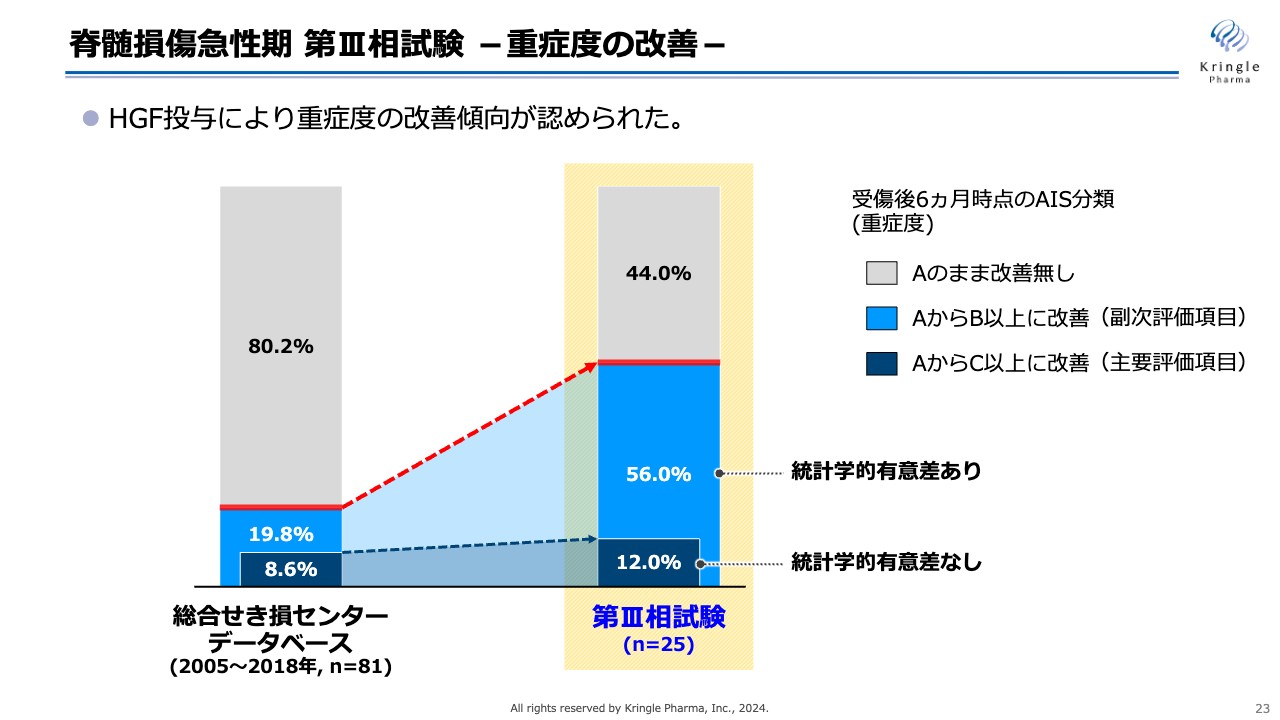
今回の第Ⅲ相試験の重症度の改善を棒グラフで示しています。この試験によって、HGF投与による重症度の改善傾向が明確に認められました。
スライド中央の棒グラフに、第Ⅲ相試験での重症度の改善割合を示しています。灰色が重症度AからAのままで改善がなかった割合、水色がAからB以上に改善した割合で、副次評価項目です。濃い青色がAからC以上に改善した割合で、今回の試験の主要評価項目です。
左側の棒グラフは、今回比較対象とした九州の総合せき損センターが保有するデータベースの数字です。今回の試験の主要評価項目であるAからC以上の改善については、第Ⅲ相試験の結果は12パーセントと、データベースの8.6パーセントよりは増加しましたが、統計学的な有意差はありませんでした。
一方で、副次項目であるAからB以上への改善については、データベースの19.8パーセントから56パーセントと非常に大きな増加が見られ、統計学的な有意差が認められました。
脊髄損傷急性期 第III相試験 -重症度の改善、前相との比較-
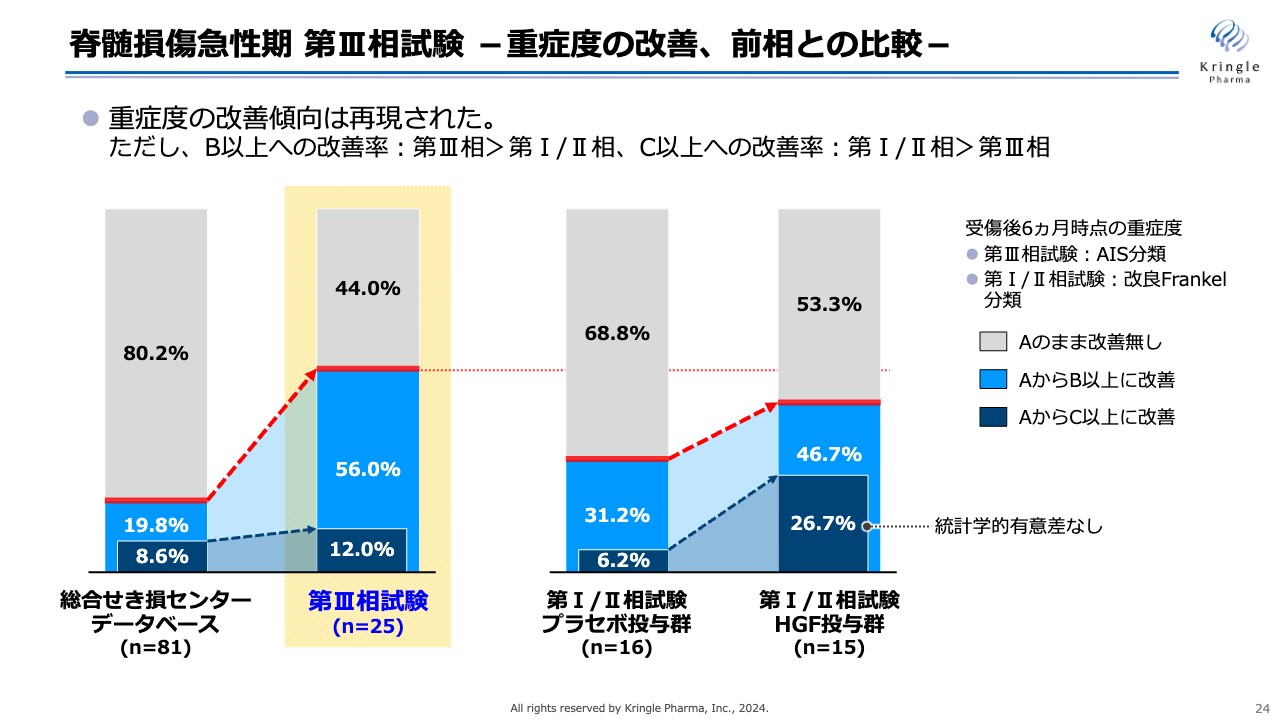
スライドは重症度の改善傾向を前相と比較したものです。左側の2本の棒グラフは、先ほどのスライドをそのまま用いています。右側の2本が前相フェーズである第Ⅰ/Ⅱ試験の結果で、左側がプラセボ投与群、右側がHGF投与群です。
前相でも、AからB以上、あるいはAからC以上への改善傾向は認められ、特にAからC以上への改善率が非常に高い結果でした。なお、n数が少ないため、増加について統計学的な有意差はありません。
今回の第Ⅲ相試験でも、重症度の改善傾向は明確に再現されています。ただし、細かく見ると、AからB以上への改善については、前相よりもむしろ高い値を示しているものの、AからC以上の改善については、前相では非常に大きく増加したのに対し、今回は統計学的な有意差を得るまでの増加は得られませんでした。
脊髄損傷急性期 第III相試験 -重症度の改善、海外データベースとの比較-

重症度の改善について、海外のデータベースと比較したグラフを示しています。米国と欧州のデータベースの数字が文献として報告されており、右側の2本の棒グラフで示しています。
欧州、米国ともに重症度Aの約7割の患者は引き続きAで改善がなく、AからB以上に改善した患者は約30パーセントという結果ですが、今回の第Ⅲ相試験では56パーセントの方がAからB以上に改善しています。今回の結果では、海外のデータと比べても、AからB以上の改善率が高く、非常に大きな改善が見られることがわかりました。
急性期完全麻痺患者に対するHGFの効果
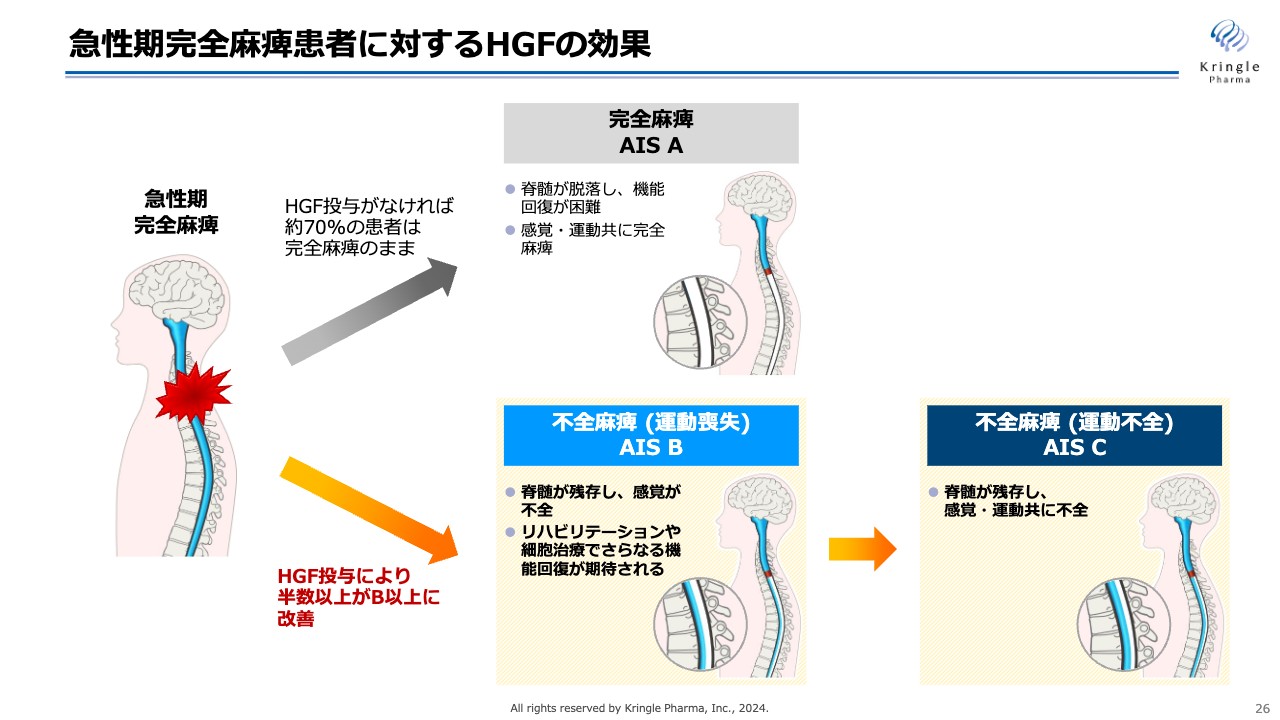
急性期の完全麻痺の患者にHGFを投与する意義をイラストで示しています。水色の部分は、脊髄の流れを示しています。
急性期の完全麻痺の頚髄損傷の方は、何もしなければ約7割の方がそのまま完全麻痺のままAIS Aへと移行します。完全麻痺AIS Aでは、脊髄が脱落して機能回復が困難になり、感覚・運動ともに完全麻痺のまま予後を過ごすという非常につらい状態になります。
一方で、HGFを投与すると、オレンジ色の矢印のケースを辿り、完全麻痺の患者が不全麻痺に移行していきます。
今回の第Ⅲ相試験でも、HGFを投与することで、半数以上の方がAIS B以上の不全麻痺に改善しています。AIS Bでは、脊髄が残存して感覚が戻ってきている状態になります。AIS Cまでいくと、脊髄がさらに残存し、感覚だけでなく運動機能も戻ってくるまでに回復します。
さらに不全麻痺では、その後のリハビリテーションや細胞治療により、さらなる機能回復が期待されるため、急性期の脊髄損傷の治療においては、完全麻痺の方をできるだけ減らして、不全麻痺のほうに移行させることが重要となります。
前相および今回の試験では、HGFを使うことによって完全麻痺を不全麻痺まで改善できることが確認できました。
脊髄損傷急性期 第III相試験 -レスポンダーの割合、前相との比較-

今回の第Ⅲ相試験ではAIS Bへ改善する方が非常に多かったのですが、AIS Bは、感覚機能は戻ってきているものの、運動機能がCまでには至らないという状態です。
スライドには、運動機能の回復についてレスポンダーの割合を示しています。運動機能のスコアである「ASIA motor score」が5点以上改善した割合と10点以上改善した割合を、今回の試験と前相プラセボ群、前相のHGF投与群で比較しています。
なお、5点以上の改善については、臨床的に意味のある改善であることが文献でも示されています。実は今回は5点以上改善する方が6割を占めており、前相のプラセボ群、HGF投与群よりもはるかに大きな数値を示しました。
一方、10点以上改善した患者の割合については、今回の試験は20パーセントと、前相のプラセボ群と同様の数字でした。前相でHGFを投与した方は、5点以上改善した方すべてが10点以上まで改善しましたので、プラセボ群と比較した場合に10点以上改善した症例割合では差異が認められましたが、5点以上の改善では差がありませんでした。
今回は5点以上改善する方は明確に増えているものの、10点まで改善するには至りませんでした。
このように重症度の改善傾向と「ASIA motor score」の改善傾向を前相と今回の試験で比べたところ、患者の反応に差があることがわかってきました。
脊髄損傷急性期 第III相試験 -患者背景、前相との比較①-

そこで、患者の背景について比較しました。スライド左側が年齢、右側が受傷原因を示しており、前相と今回の第Ⅲ相試験を比較しています。まず、年齢分布について今回の試験で顕著だったのが31歳から45歳の壮年層の割合が19.2パーセントと、非常に増加しています。
また、今回の試験では76歳以上の高齢者も増えています。前相では年齢の上限を75歳に区切っていたため、そもそも76歳以上の方は組入れていなかったのですが、今回は患者の組入れを加速することを考え、76歳以上の患者も組入れました。
一方、受傷原因においても明確な差異が認められています。最も重要なのは、前相では転落・転倒による脊髄損傷が非常に多かったのに対し、今回は転落・転倒の割合が減少し、交通事故やその他の事故の患者の割合が大きく増えたことです。
脊髄損傷急性期 第III相試験 -患者背景、前相との比較②-
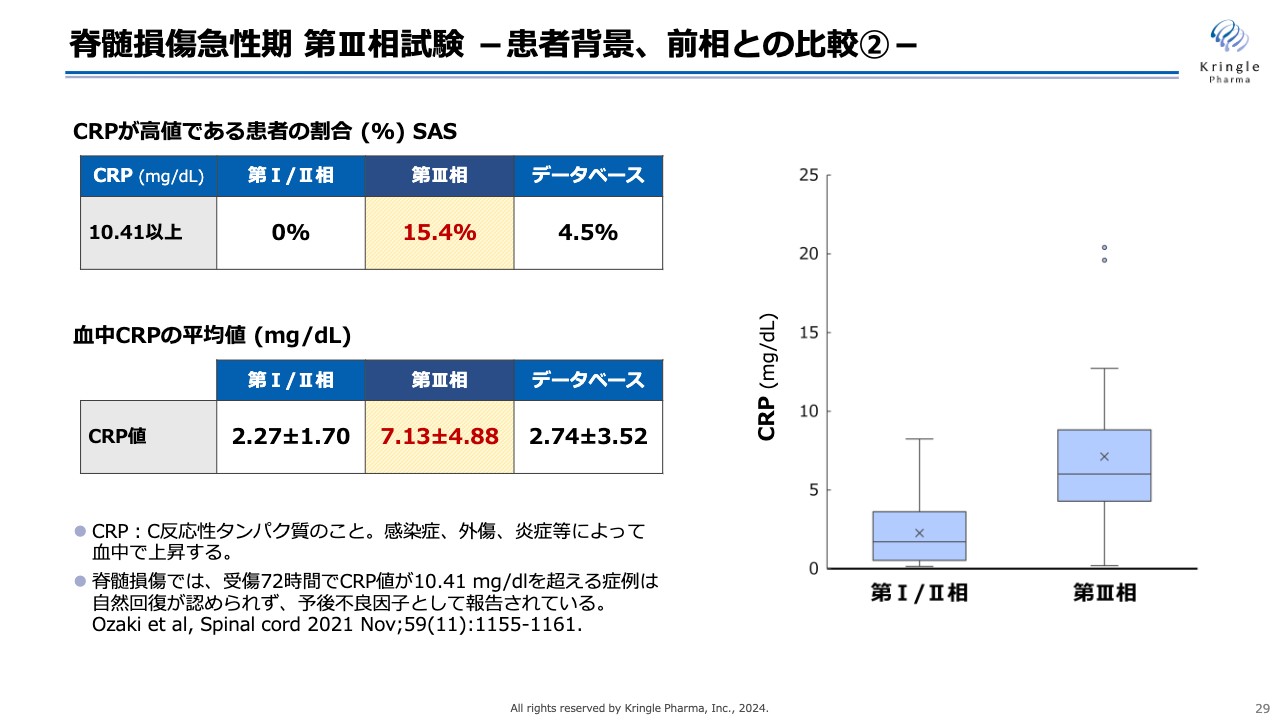
さらに患者の背景について細かく調べたところ、非常に興味深い事実がわかってきました。スライドは、「C反応性タンパク質」と呼ばれるCRPの血中の値を、第Ⅰ/Ⅱ相、第Ⅲ相、データベースで比較したものです。CRPは、感染症や外傷、炎症などによって、血中で上昇することが知られています。
脊髄損傷については、受傷72時間後のCRP値が10.41以上と高値の患者は、その後自然回復が認められず、予後が不良になることが文献として報告されています。
今回の第Ⅲ相試験では、CRPが閾値を超える患者が15.4パーセント含まれていましたが、前相では0パーセント、データベースでも4.5パーセントと、CRP値が高値の方が非常に多かったことがわかりました。
患者全体の平均値を見ても、今回は7.13mg/dL、第Ⅰ/Ⅱ相が2.27mg/dL、データベース2.74mg/dLと、スライド右側のグラフにも示しているように、今回の第Ⅲ相試験は、CRP値が高値の予後が不良な方が非常に多く含まれていたことがわかってきました。
脊髄損傷急性期 第III相試験 -患者背景に関する考察-

患者背景の差異についての考察です。前相の第Ⅰ/Ⅱ相試験は、高齢者の転倒・転落などの患者が多く組入れられました。
これらの患者は、いわゆる中心性頚髄損傷と呼ばれる脊髄損傷です。これは脊髄の中心部だけが非常に圧迫されて脊髄損傷になるというもので、上肢よりも下肢のほうが回復しやすい傾向があります。そのため、下肢の運動機能に着目した簡便な分類方法である改良Frankel分類がCまで回復した症例が多く、「ASIA motor score」でも、10点以上まで改善する症例が多かったと考察します。
一方で、今回の第Ⅲ相試験では、高齢者よりも壮年層の方で、交通事故などの高エネルギー外傷を伴う脊髄損傷の重症度Aの中でも、さらに重度な症例が多く含まれたのではないかと考えています。
このような高エネルギー外傷を伴う脊損、より重度な患者においては、AIS Bまで改善した症例、あるいは「ASIA motor score」が5点以上改善した症例は明確に増えたものの、AIS C、あるいは「ASIA motor score」が10点以上改善するまでには至らなかったのではないかと考えています。
脊髄損傷急性期 第III相試験 -まとめと今後の方針-

第Ⅲ相試験のまとめと今後の方針についてです。有効性については、主要評価項目であるAIS C以上への改善に有意差は認められませんでした。一方で、副次評価項目であるAIS B以上への改善については、非常に大きな改善・有意差が認められました。
安全性については特に大きな問題はなく、HGF投与に起因する重篤な有害事象や死亡例はなく、安全性・忍容性が確認されています。
今回の第Ⅲ相試験はコロナ禍で行ったため、その影響を受け、第Ⅰ/Ⅱ相試験とは患者背景が異なっていたと考えられます。これが第Ⅰ/Ⅱ相試験の結果との差異要因ではないかと推測しており、今後、患者背景の差異を考慮して、さらなる層別解析を実施していきます。
今回の試験に対する当社の見解として、安全性に加えて、HGFの有効性が検証できたと考えています。今後の方針については、今回の試験をまとめて、PMDAとその後の製造販売承認申請に向けて協議を行いたいと思います。
現在、製造販売承認申請に向けた準備をすでに着々と進めており、今後も継続していきます。
2024年9月期第1四半期の主なニュースリリース(後発事象を含む)

2024年9月期第1四半期の決算概要についてご説明します。スライドには、第1四半期の主なニュースリリースをまとめています。2023年10月には、脊髄損傷急性期での第Ⅲ相臨床試験の最終観察日が終了しました。
2023年10月には、慶應義塾大学との共同研究成果が新たに論文掲載されています。こちらはラットモデルにおいて、急性期にHGFを投与し、その後亜急性期にiPS細胞由来神経幹/前駆細胞を移植することで、細胞移植単独治療よりもさらに大きな機能回復を得ることができたというものです。
2023年11月には、HGFの新たな製造方法に関する特許の優先権主張出願を済ませています。
同じく2023年11月には、脊髄損傷急性期に対する米国での開発に関して、米国FDAよりpre-INDミーティングにかかる回答を受領しました。これをもとに、現在米国での開発戦略を構築しています。
2024年1月には、協業先である米国のクラリス社より資金調達の完了、および今後の臨床試験の予定についてリリースされました。
2024年9月期第1四半期 経営成績の概況

第1四半期の経営成績の概況について、損益計算書の概要として前年対比で示しています。第1四半期の売上は1,800万円、内容としては、クラリス社からの技術アクセスフィーです。
販売管理費は1億8,700万円、うち研究開発費が1億2,800万円です。内容としては、脊髄損傷の治験費用および米国での開発に係る準備費用、声帯瘢痕の治験費用、製造開発に係る各種試験費用を計上しています。
営業損失はマイナス1億6,800万円、経常損失ならびに四半期純損失が、マイナス1億6,900万円と、概ね計画どおり進捗しています。
2024年9月期第1四半期 財政状態の概況
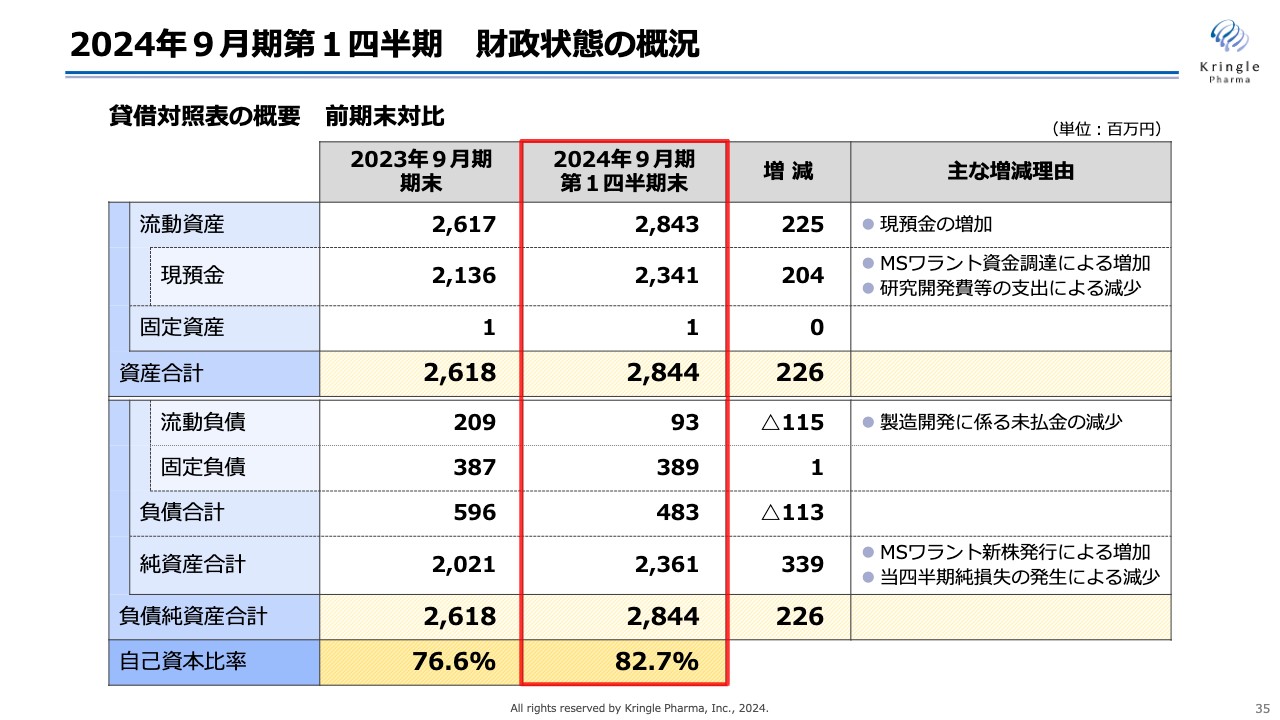
第1四半期の財政状態の概況です。貸借対照表の概要を前期末対比で示しています。第1四半期末における流動資産の合計は28億4,300万円、うち現預金が23億4,100万円となっています。
現預金の増減の主な要因は、MSワラント資金調達による増加、研究開発費等の支出による減少によるものです。現預金の増加に伴い、流動資産が増えています。資産合計は28億4,400万円となりました。
負債については、流動負債9,300万円、固定負債3億8,900万円で、負債合計は4億8,300万円となりました。流動負債の減少要因は、製造開発に係る未払金の減少によるものです。
以上、純資産合計は23億6,100万円、負債純資産合計は28億4,400万円、自己資本比率は前期末76.6パーセントから増加し、82.7パーセントとなっています。
クリングルファーマのビジョン
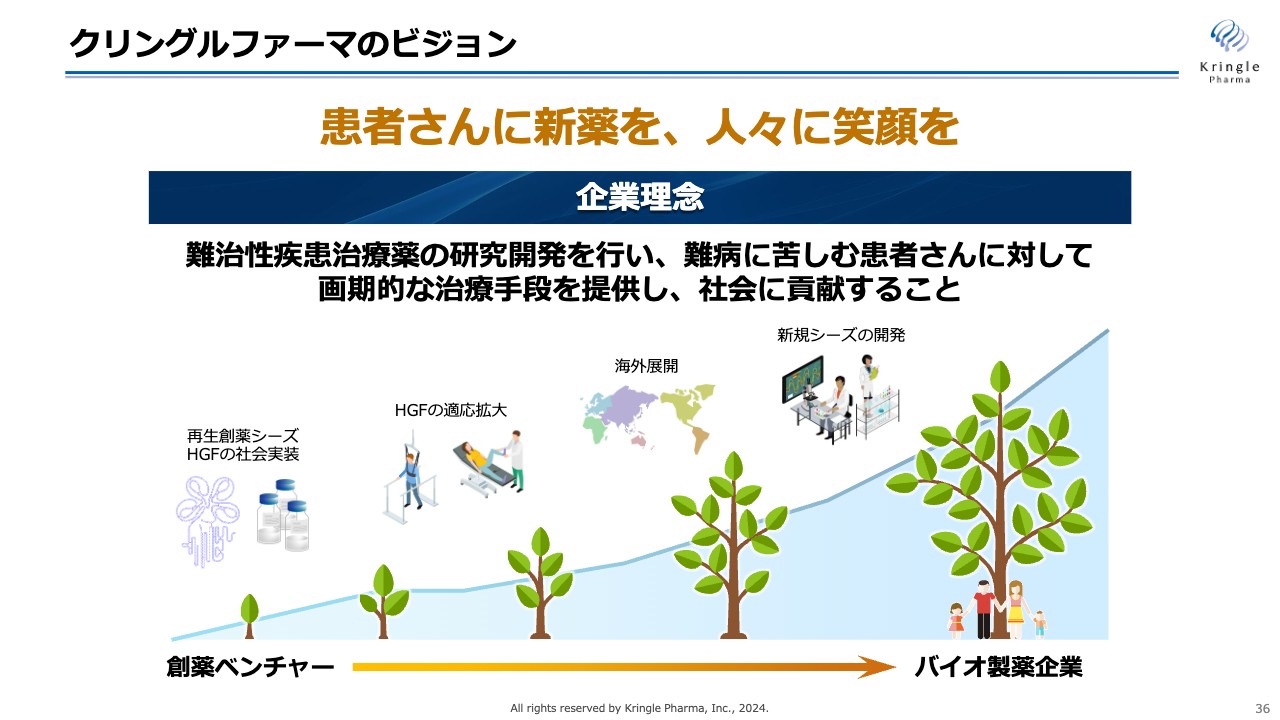
クリングルファーマのビジョンは、「患者さんに新薬を、人々に笑顔を」届けることです。
当社は現在、再生創薬シーズHGFの社会実装に注力しており、再生創薬ベンチャーから最終的にはバイオ製薬企業へ成長していくことを考えています。
当社の成長戦略は、HGFの適応拡大、海外展開によって成し遂げます。最終的には、新規シーズをさらに自社で開発し、開発から販売まで一気通貫で担えるバイオ製薬企業への成長を目指します。今後ともご支援のほど、よろしくお願い申し上げます。
ご清聴ありがとうございました。
この銘柄の最新ニュース
クリングルのニュース一覧- 前場に注目すべき3つのポイント~過熱警戒も押し目待ち狙いの買い意欲は強い~ 2026/01/14
- 譲渡制限付株式報酬としての新株式の発行の割当完了に関するお知らせ 2026/01/13
- 声帯瘢痕に対するHGF(肝細胞増殖因子)の第III相臨床試験における最終症例の組入れ完了のお知らせ 2026/01/09
- 第三者割当により発行された第16回新株予約権(行使価額修正条項付)の月間行使状況に関するお知らせ 2026/01/05
- 2025年【値下がり率】年間ランキング ベスト50 <年末特別企画> 2025/12/31
マーケットニュース
- 明日の株式相場に向けて=衆院選リスクにも強い「コモディティ関連株」再評価 (01/26)
- 東京株式(大引け)=961円安と3日ぶり大幅反落、円急伸で下げ幅一時1100円超 (01/26)
- 日本が23日に為替介入した明確な形跡なし-日銀当座預金見通し (01/26)
- 26日香港・ハンセン指数=終値26765.52(+16.01) (01/26)
おすすめ条件でスクリーニングされた銘柄を見る
クリングルファーマの取引履歴を振り返りませんか?
クリングルファーマの株を取引したことがありますか?みんかぶアセットプランナーに取引口座を連携すると売買履歴をチャート上にプロットし、自分の取引を視覚的に確認することができます。
アセットプランナーの取引履歴機能とは
※アセプラを初めてご利用の場合は会員登録からお手続き下さい。



