【QAあり】PRISM BioLab、製薬会社2社と共同研究契約を締結 新株発行、アップフロント等により今後の研究開発費を確保
2024年9月期決算説明
竹原大氏(以下、竹原):みなさま、こんにちは。本日はPRISM BioLabの2024年9月期決算説明会にご参加いただき、誠にありがとうございます。代表取締役社長の竹原です。本日は資料に沿ってご説明します。
企業理念
当社の企業理念をあらためて作り直しました。「Purpose」は、当社が存在する価値、もしくは社会的な意義で、「PepMetics技術を活用して、だれもが希望に満ちた生活をするための新薬を創出します」としました。
この「Purpose」を達成するための「Mission」は、「私たちは、自由な発想と積み重ねた技術で『あたらしい創薬』に挑戦し続けます」としました。
この「Mission」を果たすために、組織としての「Vision」を作っています。それが「『あたらしい研究』にチャレンジできる舞台に、多様な才能が集い、世界の新薬創出をリードします」です。
当社はおかげさまで、日本でもトップクラスの優秀なサイエンティストたちに集まってもらっています。新しい薬を創ることは極めて大変なことであり、確率が高くないものに対してできる限り挑戦しようというものです。
そのため、彼らの力を十分に発揮してもらえる舞台をいかに作っていくかが、経営として大変重要だと思っています。
2024年9月期のハイライト

2024年9月期のハイライトです。当期は2社の製薬会社と共同研究契約を締結しました。2023年11月には、イーライリリー・アンド・カンパニー(Eli Lilly and Company 以下、Lilly社)と、最大3つの標的に対して6億6,000万ドルのマイルストンとロイヤリティを受け取る契約を結んでいます。
また今年5月には、小野薬品工業とも共同研究のライセンスを契約しました。このようなグローバルなトップクラスの会社と、研究がどんどん進んでいくことを大変うれしく思っています。
それに加え、財務的には2度の資金調達を行いました。1度目は2024年1月に、Lilly社とSantec Holdingsから、合計15億円の増資をいただいています。Lilly社には提携関係を通じて、我々の技術を高く評価していただいており、大変ありがたく思っています。その期待に応えたいと思っています。
また7月2日には、東京証券取引所グロース市場へ新規上場しました。
小野薬品および Eli Lilly とのライセンス・共同研究契約締結

スライドは、2つの共同研究契約に関するリリース内容です。
2024年9月期 通期 損益状況
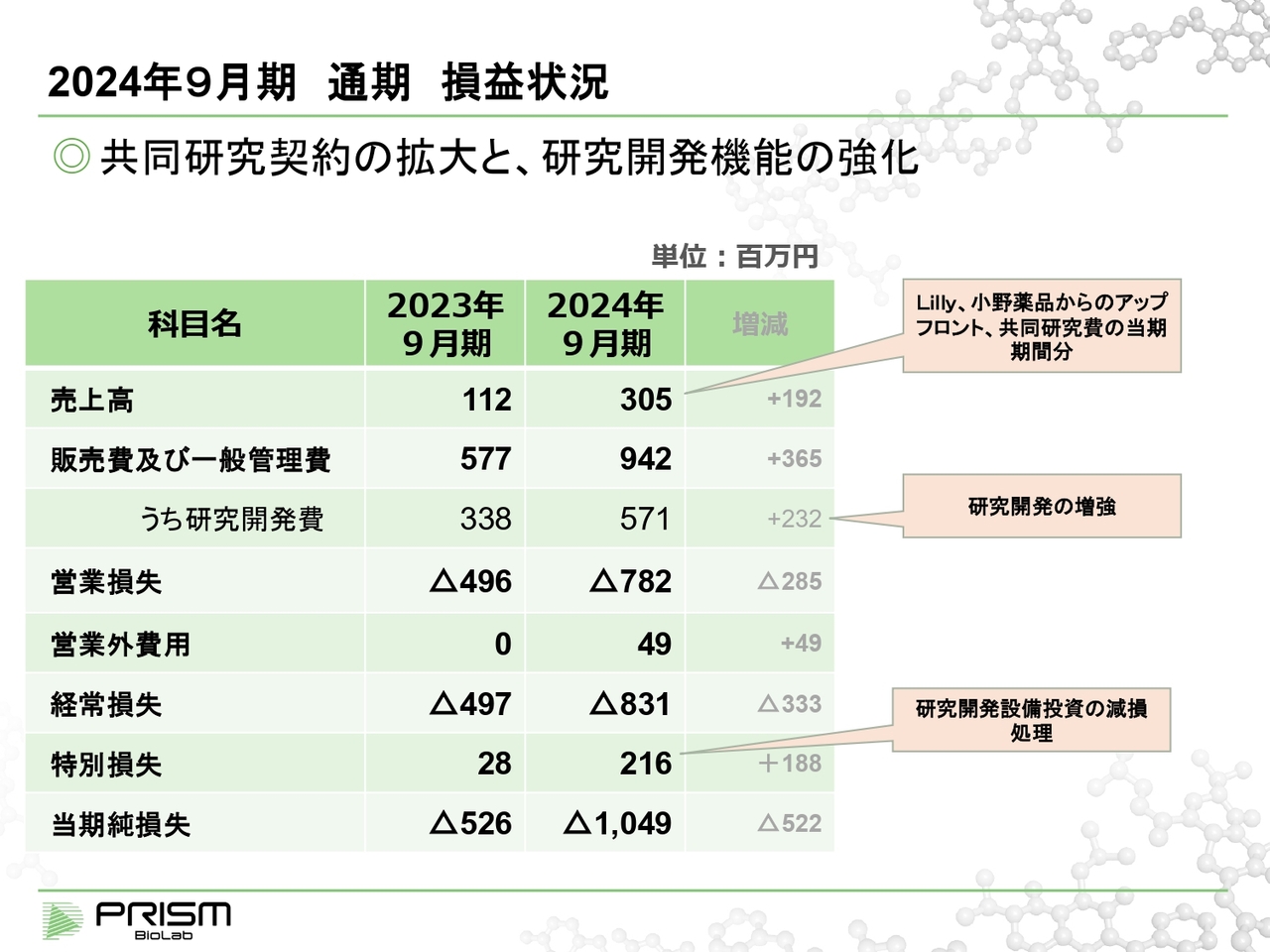
当期の業績についてご説明します。売上高は3億500万円となりました。売上・利益については、上場した7月に開示した見通しとほぼ一致している状況です。収益的には1億円ほど改善しています。
売上の約3億円には、Lilly社ならびに小野薬品工業からのアップフロントと共同研究費が含まれています。
2つの契約で3億円は小さいように思われるかもしれませんが、我々への実際の入金はさらに大きな金額です。共同研究が数年にわたる場合には、期間に応じた分を各期に計上する、期間按分というかたちになっています。
いただいている残りの分については、バランスシートに記載されます。この金額の数倍の金額が入金されています。
費用については、共同研究を広げているため開発費が膨らんでいます。プロジェクトが増えて事業が拡大するにつれて、研究開発の部隊や設備、さまざまな実験などが重要になってきます。そこに対しては十分な投資ができるように心がけています。
また特別損失については、当期は約2億円計上しています。損失というとネガティブなイメージですが、実際には前向きな設備投資です。先ほどお話しした研究開発の一環である、バイオロジー、さらにケミストリーのさまざまな設備を自前で持つことにより、研究開発の効率を高めています。
設備投資は資産計上されて、期間に応じて償却されるのが一般的ですが、バイオベンチャーの財務構造上、どうしても赤字が先行してしまいます。黒字の見通しが確実ではない場合には、会計のルールとして、投資した期に減損することになっています。
そのため、こちらは損失とはなっていますが、我々は前向きな投資と考えています。
2024年9月期 通期 財政状況
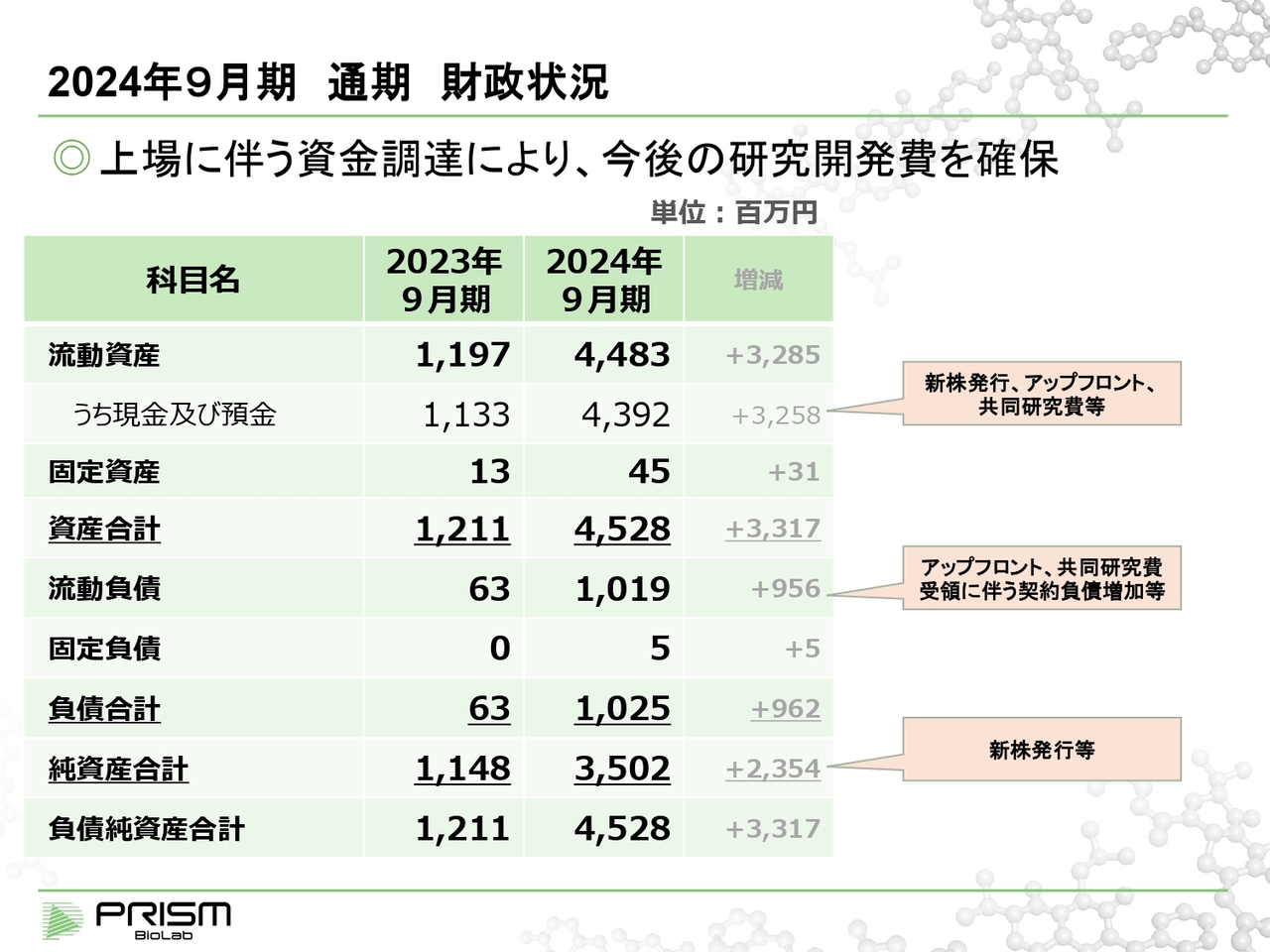
財政状況です。現金及び預金は、2023年9月期の約11億円から2024年9月期には約44億円になり、約32億円増加しています。これは増資や契約金から、実際に使ったお金が引かれたかたちで、このような結果になっています。
先ほどお話しした、アップフロントや共同研究費の受領に伴う、まだ売上に入っていない部分は、流動負債の中の前受金に計上されています。これも負債となっているため、返さなければいけないお金のように感じますが、このような契約金は返す必要がないものです。契約金が残っている前受金の部分が、翌期以降の売上に変わっていくものと受け止めていただければと思います。
また、新株発行等から出費を除いた部分が、最終的な純資産合計として増加しています。
2024年9月期 通期 キャッシュフロー状況
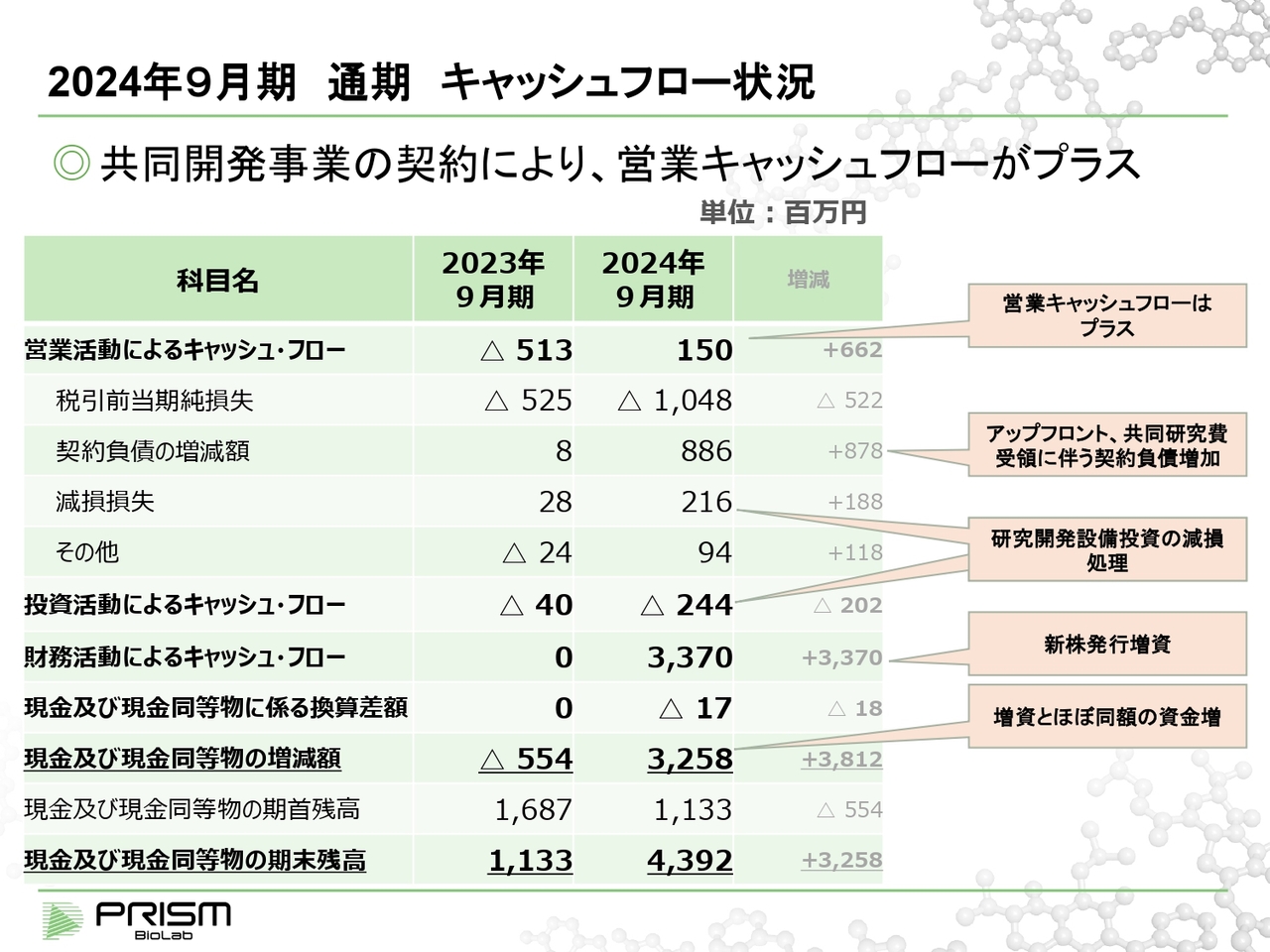
キャッシュ・フローステートメントについてご説明します。当期は約10億円の税引前当期純損失となっていますが、契約負債が前受金というかたちで約8億8,000万円増加しており、これは翌期以降の収益になっていく部分になります。
当期の売上は約3億円というかたちですが、前受金に将来の売上の素が入っているため、進行期については、基本的に増収がほぼ見通せる状況になっています。
先ほどお話しした設備投資が、減損というかたちで当期のマイナスになっていますが、実質的には投資活動によるキャッシュ・フローに含まれています。このようなことを考え合わせると、当期の営業活動によるキャッシュ・フローは、すでにプラスになっています。
売上の認識基準により、いただいた契約金は期間に応じて按分していくことから、P/L上の改善には時間がかかるものの、キャッシュ・フロー的には当期はプラスになっています。
また新株発行によって、約34億円の資金を調達しています。基本的には、調達資金とほぼ同額の現金の増加となっています。そのような意味では、増資した分を全部確保しながら、当期の営業キャッシュ・フローで賄ってきたことになります。結果としては、約44億円の資金が現在残っている状況です。
PepMetics があたらしい創薬領域を創る可能性

当社の「PepMetics」の技術についてご説明します。先ほど、我々は「あたらしい創薬」に取り組んでいくとお話ししました。それをどのようなかたちで行うのかを、スライドに示した3つのステップでお話ししたいと思います。
タンパク質間相互作用(PPI)は、大変有望な創薬標的であると言われています。ただし有望ではあるものの、アンドラッガブル(創薬不可能)ということで、これまでは難しい標的であると思われてきました。
このPPIを制御する上で重要な役割を担うのが、ヘリックス構造です。これはペプチドというアミノ酸がつながったものです。これは特殊な構造をしており、この中でもヘリックスが重要であることをご説明します。
「PepMetics」という我々の技術は、ペプチドを模倣する技術ですが、特にヘリックス構造を高い精度で模倣することができます。すなわち「PepMetics」を使えば、難しいと言われてきたPPIを制御することができるため、新しい創薬領域を創る可能性があることをご理解いただければと思います。
タンパク質間相互作用(以下「PPI 」)は有望な創薬標的
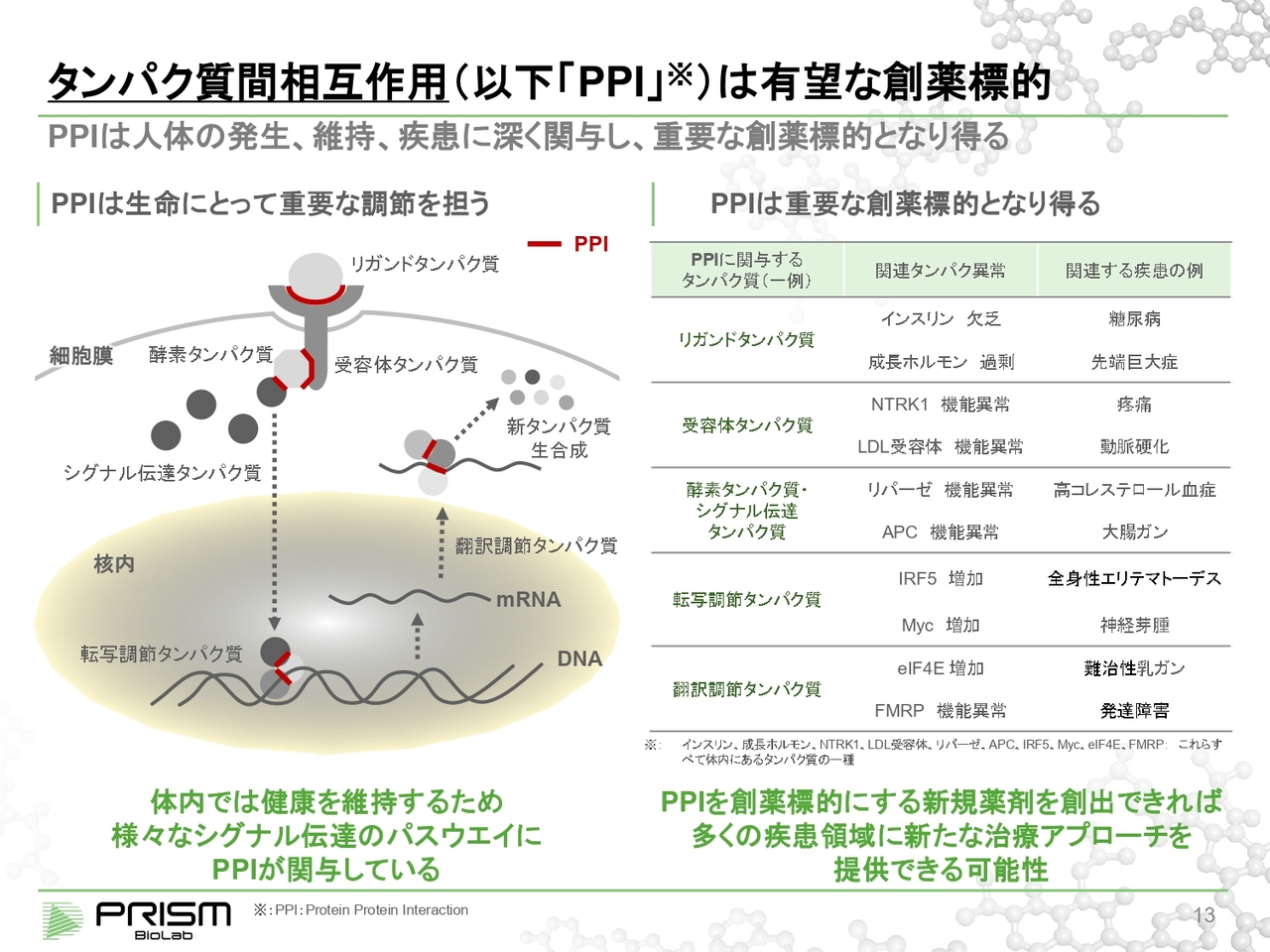
PPIについてご説明します。水とタンパク質と脂肪と骨が、ヒトの体の4大構成要素です。その中でタンパク質は、単に体を構造として作るだけではなく、体の中の信号を適切に伝えて、成長、健康維持、疾患などに対して深く関与していることが知られています。
例えば、新しいタンパク質を作る時に、リガンドタンパク質というものが、細胞の外から受容体タンパク質にくっついて、ここで信号を発します。これもタンパク質とタンパク質の結合、つまりPPIです。
受容体タンパク質、酵素タンパク質、シグナル伝達タンパク質のようなものも、選択的にタンパク質同士がくっつきます。DNAからmRNAを読み出す時に転写因子というものがあります。これは転写のコンプレックスで複合体を作りますが、この時にもタンパク質同士の結合が重要になります。これはmRNAを翻訳する時も同じです。
このように、細胞の中ではさまざまなかたちでタンパク質結合が選択的にコントロールされることで健康が維持されています。
これが崩れてしまうと、さまざまなタンパク質の異常が関連する疾患になっていきます。すなわち、これをしっかりとコントロールできれば、疾患を治すこともできることになります。
PPIで重要な役割を担うヘリックス構造
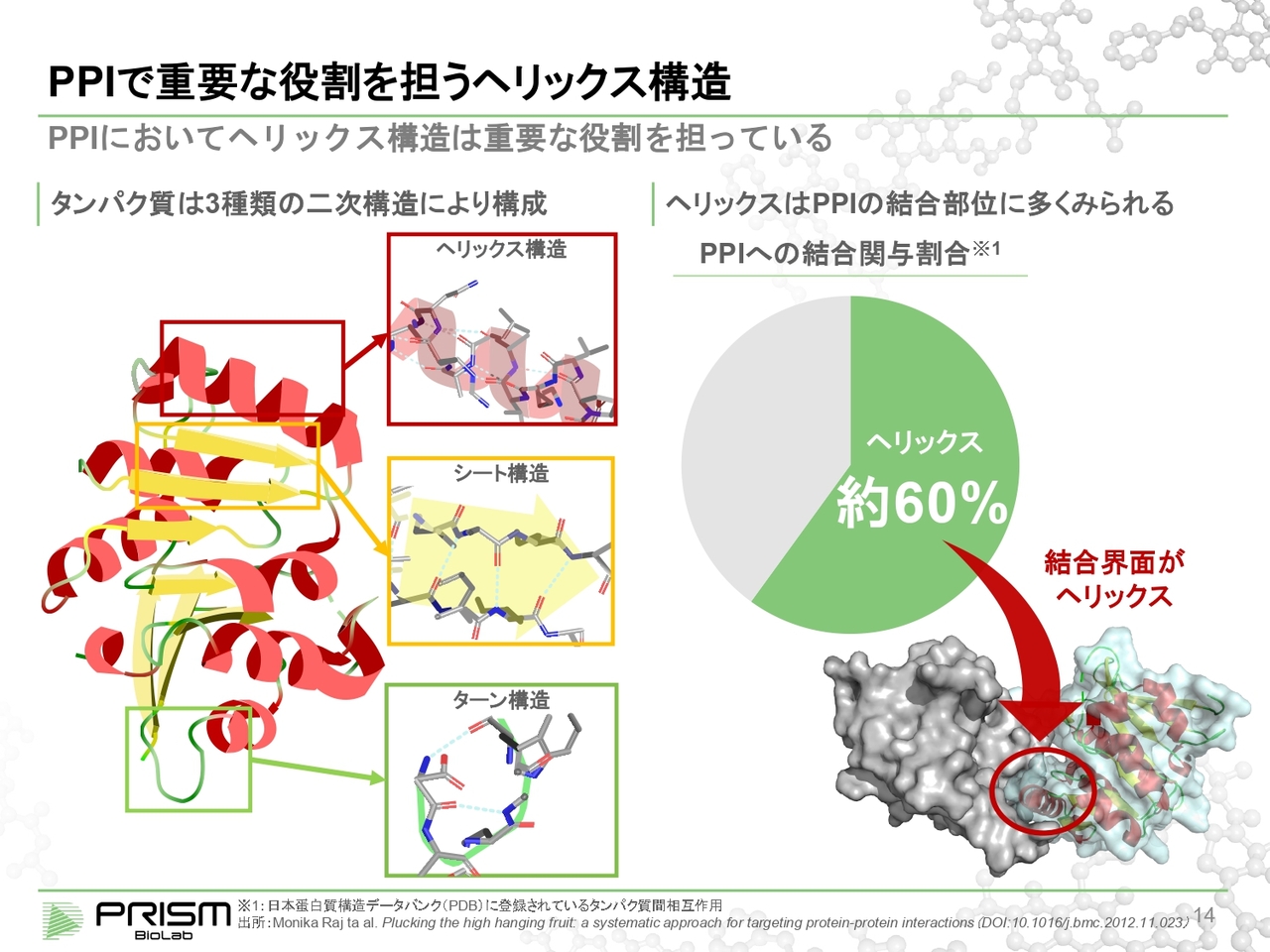
PPIを制御するには、ヘリックス構造が重要になります。タンパク質というのは、実は1本の長いアミノ酸の紐であり、数百個から数万個のアミノ酸がつながったものです。
それが特定の形にきれいに折り畳まれることによって、初めて機能します。この折り畳みはフォールディングと言いますが、これがうまくいかないと機能しません。うまくフォールディングさせるために、まずは単純な二次構造で安定的なものになります。
これは、ヘリックス構造、シート構造、ターン構造という3つの種類しかありません。これがまたパタパタと折り重なって特定の形になります。
この中で、PPIのタンパク質結合の結合界面にとって重要なのが、ヘリックスだと言われています。約6割のPPIでヘリックスが重要な役割を果たしています。
すなわち、このヘリックスをまねて、代わりに入って結合を阻害すれば、コントロールできるということになります。
当社のプラットフォーム基盤技術「 PepMetics テクノロジー 」
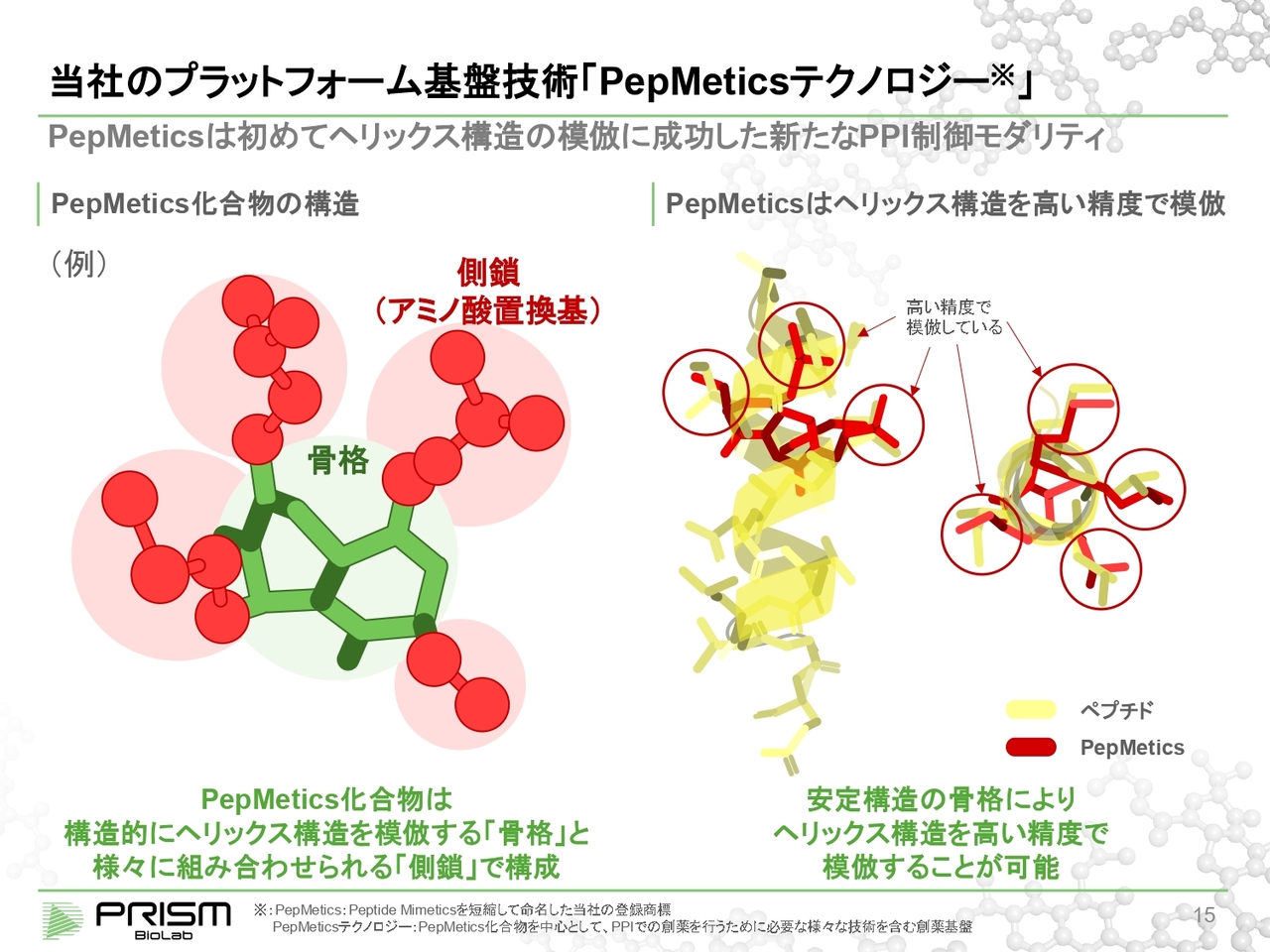
ヘリックス構造は、螺旋の形をしており、約4つのアミノ酸で1回転になります。これを模倣するためには、四方八方に手が生えている、立体的な構造が必要になります。しかし従来の低分子はほとんどが平面的な構造であるため、このようなヘリックス構造をまねするような低分子はなかなか存在しませんでした。
そこで我々は、スライド左側の図に示すように、2つの輪が特定の角度を持って、安定して結合するような「骨格」を作り、ここに3つから5つのアミノ酸側鎖が出せるような構造を作っています。
これにより、立体的にこのアミノ酸のヘリックス構造をまねることができるようになり、化合物でヘリックス模倣ができるようになりました。
化合物の設計における PepMetics の柔軟性
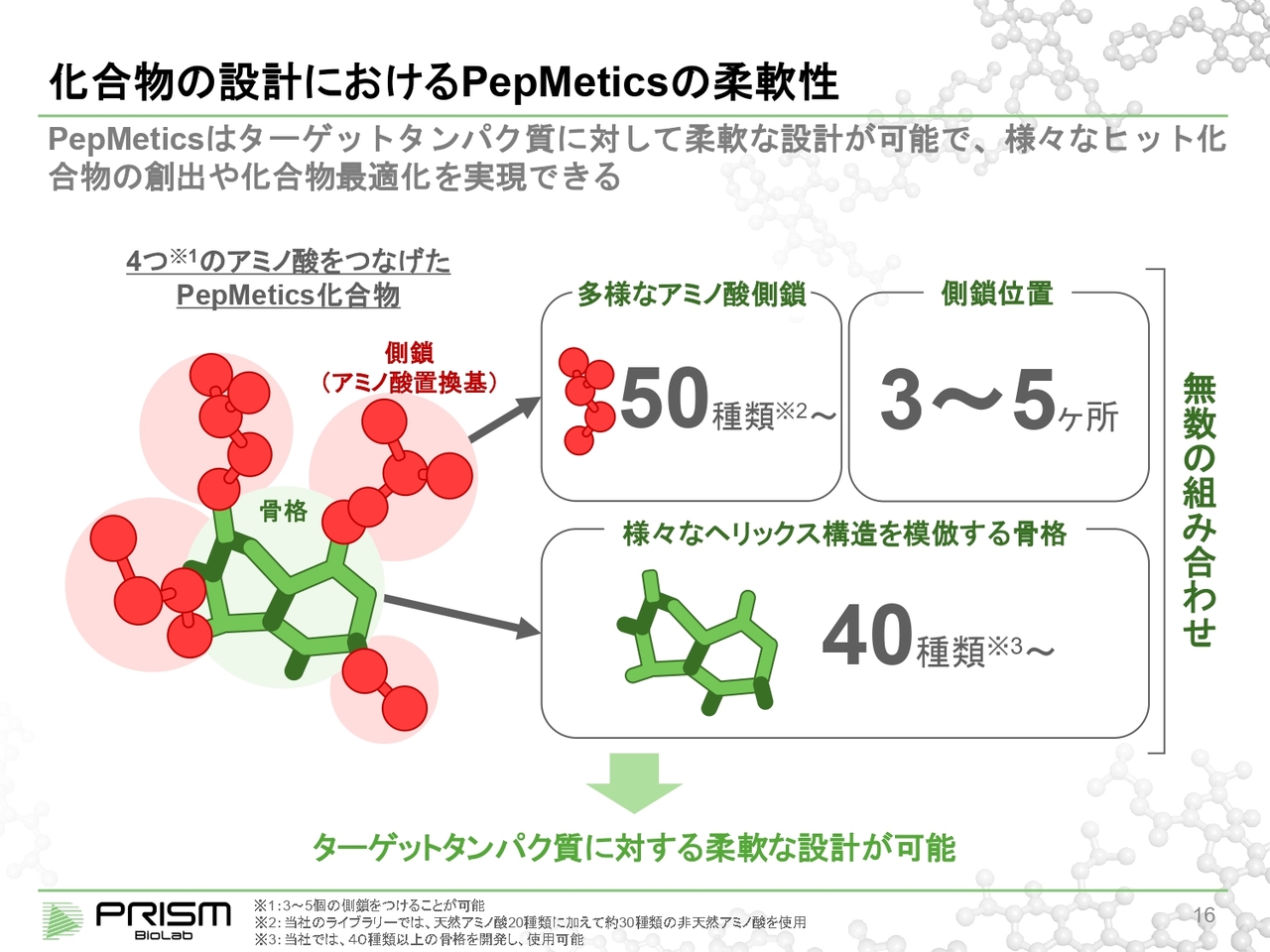
現在、約40種類以上の「骨格」を作っており、特許で押さえています。また、標準的に50種類ほどのさまざまなアミノ酸側鎖を用意しています。例えば、ある「骨格」に4つのアミノ酸を加えると、40種類×50種類の4乗で、2億5,000万種類もの組み合わせができます。
その中から、現在は約2万6,000種類の化合物をライブラリとして合成しており、スクリーニングが可能になっています。
「細胞内」 PPI をターゲットとする創薬の課題
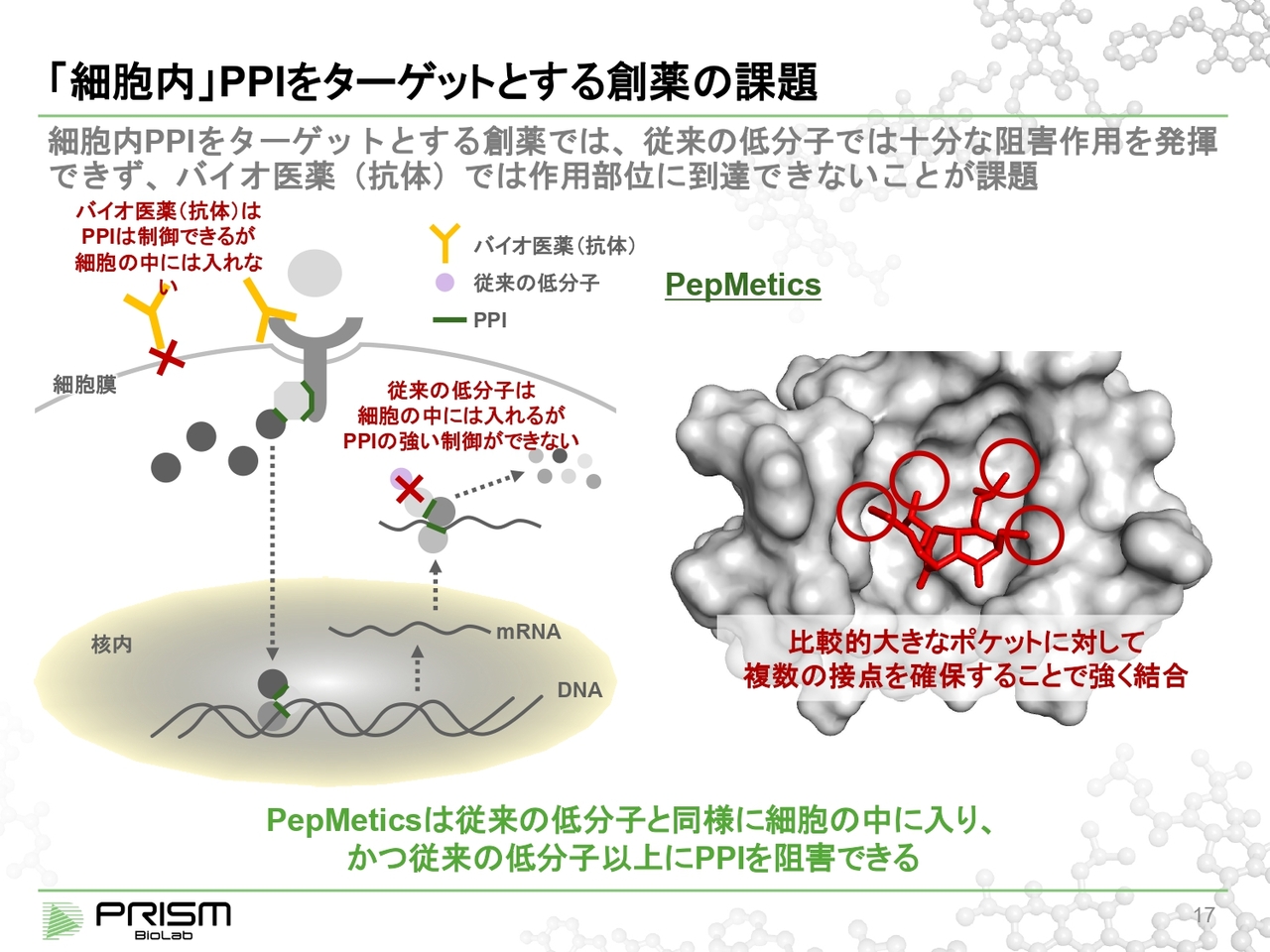
従来、PPIは低分子では難しいということから、抗体やタンパク医薬を使って制御していました。リガンドタンパク質と受容体タンパク質のようなものはできるものの、分子が大きいため細胞の中に入れませんでした。
そのため、細胞の中にあるPPIを制御する方法はありませんでした。しかし我々の化合物はその細胞の中に入ってPPIを制御することができます。
例えば、スライド右図のグレーの部分がタンパク質で、従来の低分子からすると大きすぎてなかなか制御することができないと言われるものになります。
図の中心はもともとヘリックスのタンパク質が入る穴を示していますが、我々の化合物はヘリックスをきれいに模倣することにより、複数の点で同時に結合することができるため、制御することが可能になっています。
細胞内 PPI に対する他モダリティとの比較優位性
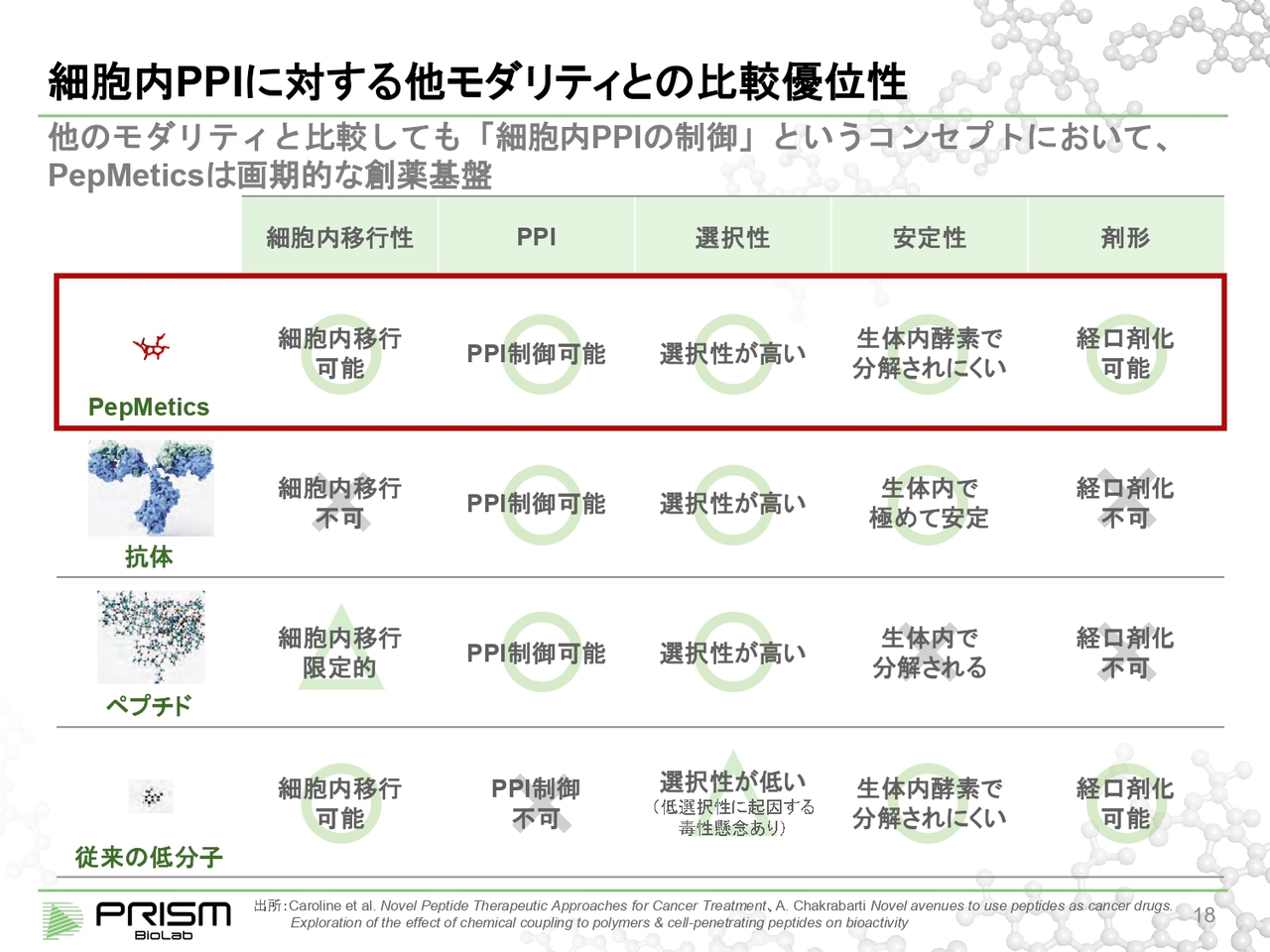
従来の低分子は細胞の中に入ることはできるものの、PPIの制御ができません。反対に、PPIの制御ができる抗体やペプチドは、細胞の中に入ることができなかったり、安定性に問題があったりということで経口剤にはなりません。
しかし「PepMetics」の場合は、それらをすべて満たすような構造が可能になります。
天然物に類似する構造を有する PepMetics
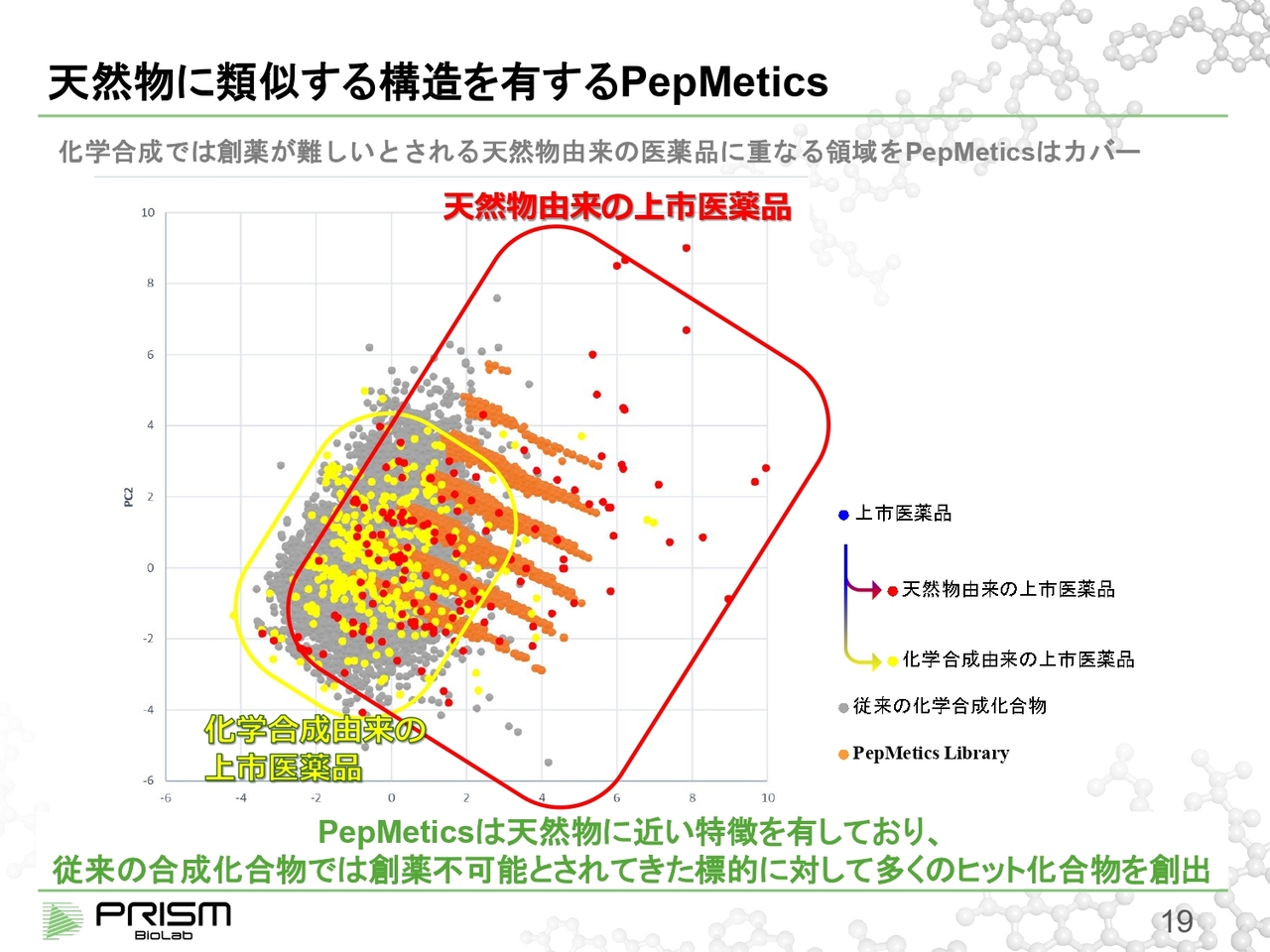
スライドの図は、従来の低分子との違いをわかりやすくご説明するために、すでに承認された低分子の医薬品を、二次元上に数学的なモデルを使って分散させたものです。グレーの点が従来の化学合成化合物です。
そこに、ハイスループットスクリーニングなど、通常いろいろなスクリーニングで使われる低分子といわれるものを重ね合わせてみると、きれいに重なります。実際にこのような低分子から薬がたくさん作られてきているのも事実です。
そこにオレンジ色の点で示した我々の化合物である「PepMetics」を重ねると、かなり右のほうにずれていることがわかります。この領域は何かというと、上市医薬品を天然物由来のものと合成物由来のものに分けた時に、「PepMetics」が主にカバーしているのは、従来天然物でしかアプローチできなかった領域をまねているということがわかります。
実は、天然物は見つけることが難しいのですが、合成も極めて難しく、なかなか薬にしにくいのが現状です。それに対して我々の化合物は、合成ルートがしっかりしているため、見つけやすいかたちで使えるようになっています。
当社のビジネスモデル
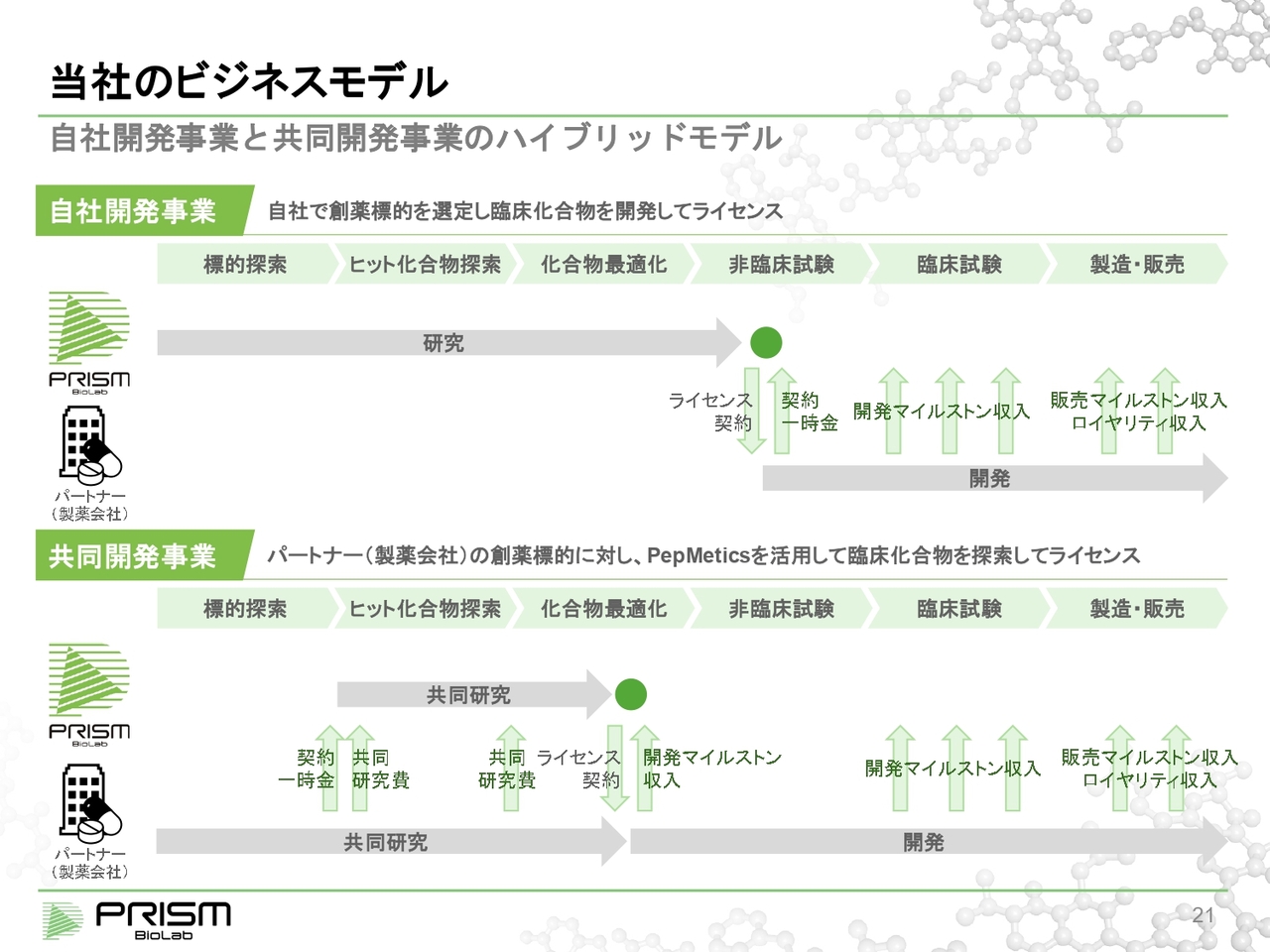
このような技術を使って展開している、当社のビジネスモデルについてご説明します。当社では、自社開発事業と共同開発事業の2つのハイブリッドモデルでビジネスを展開しています。
自社開発事業は、自ら標的を探索し、それに対するヒット化合物を見つけ出します。臨床候補化合物という薬のもとになるものまで見つけて、そこからパートナーの製薬会社にライセンスアウトします。この時点で、数十億円から数百億円という大きなアップフロントが期待できるものにできる可能性が十分にあります。
しかし、スライド上部に記載している「研究」の期間には、およそ3年から5年にわたって投資をしなければなりません。創薬というのは、確率論的には極めて難しいものであるため、ハイリスク・ハイリターンな事業モデルになります。
それに対して共同開発事業は、パートナー会社がすでに標的を持っているものの、ほかの方法でなかなかヒット化合物が見つからなかったというところに対して、当社の技術を使って一緒にヒット化合物を作って最適化していき、パートナー会社に商業化してもらうというパターンになります。
この場合、プロジェクト単位で見ると、すでにはじめの段階から黒字化していきますので、事業的には大変安定するかたちになります。
当社の各事業の特徴
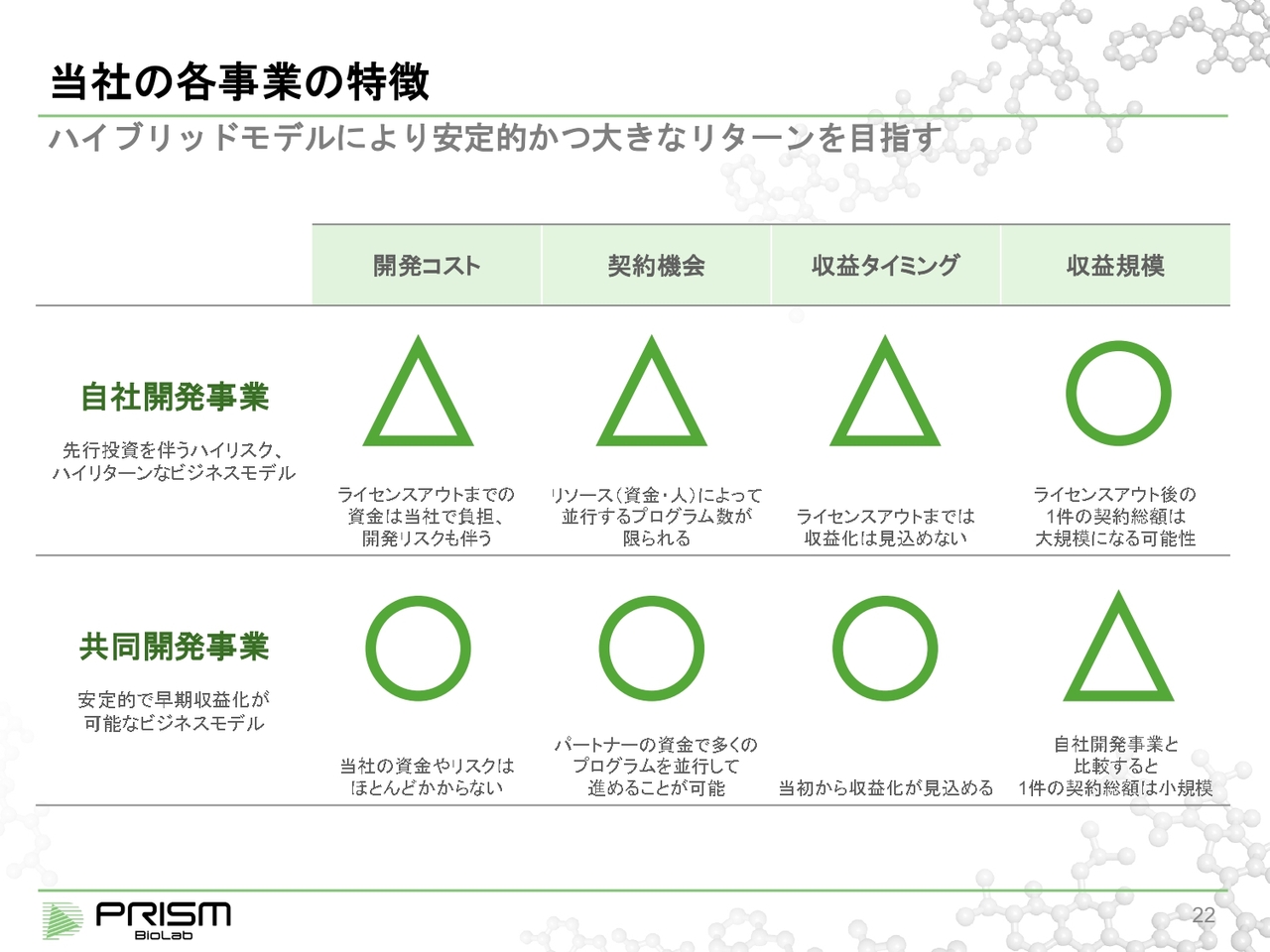
共同開発事業は、収益的には自社開発事業に比べて少しミドルリターンというかたちになります。
自社開発事業のハイリスク・ハイリターンのモデルと、共同開発事業の安定的でミドルリターンのモデルを組み合わせることで、安定的に成長しながら、将来的な大きな価値を生み出そうというビジネスモデルになっています。
自社開発から共同開発への展開
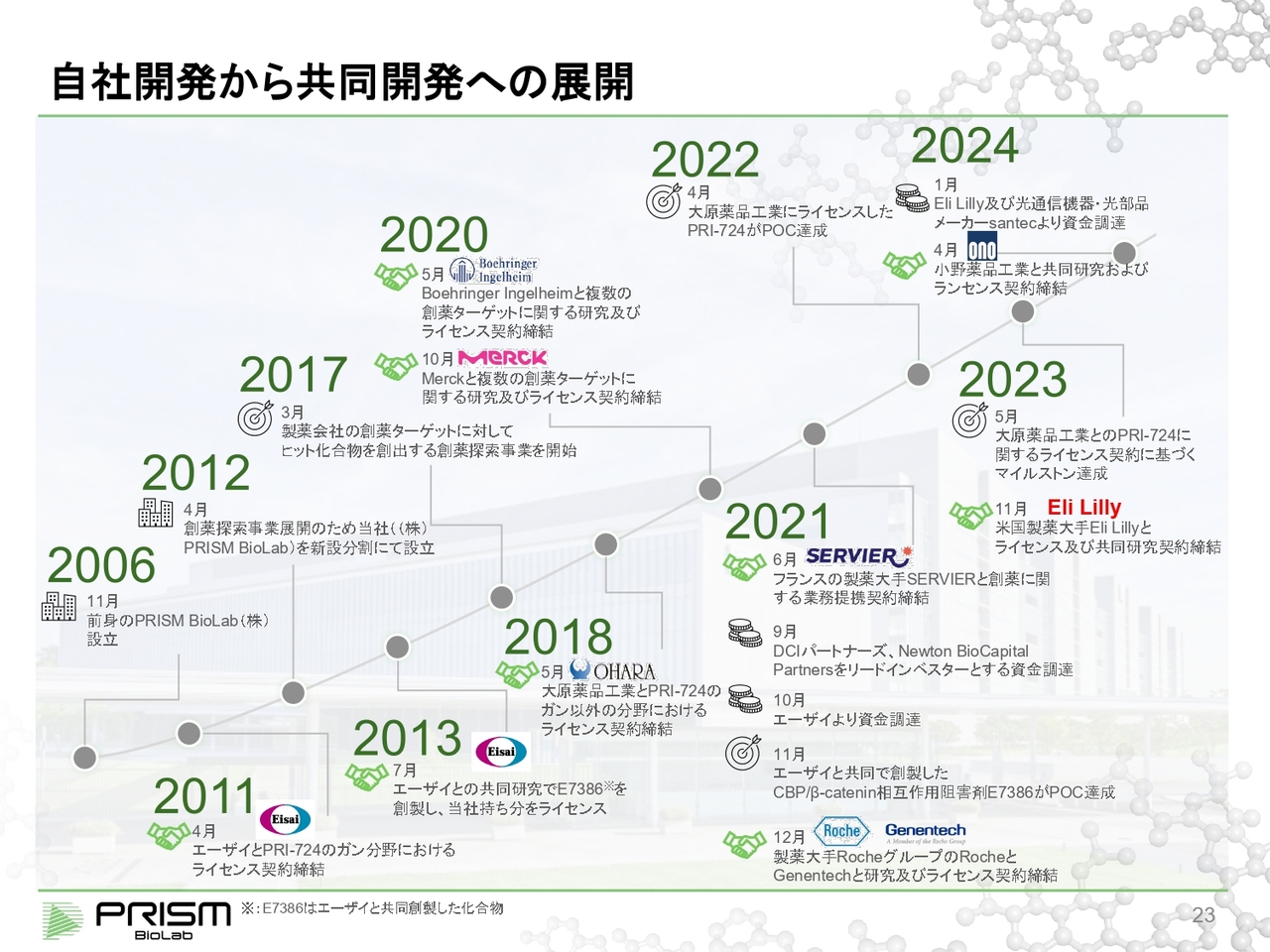
当社は歴史的に見ると、当初は自社開発から始めて、そこで実績を作っていきました。そしてエーザイや大原薬品工業との契約もあり、それをベースに共同開発事業に展開していきました。
自社開発事業

パイプラインの進捗についてご説明します。先ほども少し触れましたが、当社の自社開発事業で創業当時から開発してきたものの中で、2つがすでにライセンスアウトされています。臨床試験で第Ⅱ相試験を実施しており、両方ともPOC(Proof of Concept)を達成しており、人に対しての効果が確認されています。
自社開発事業: E7386
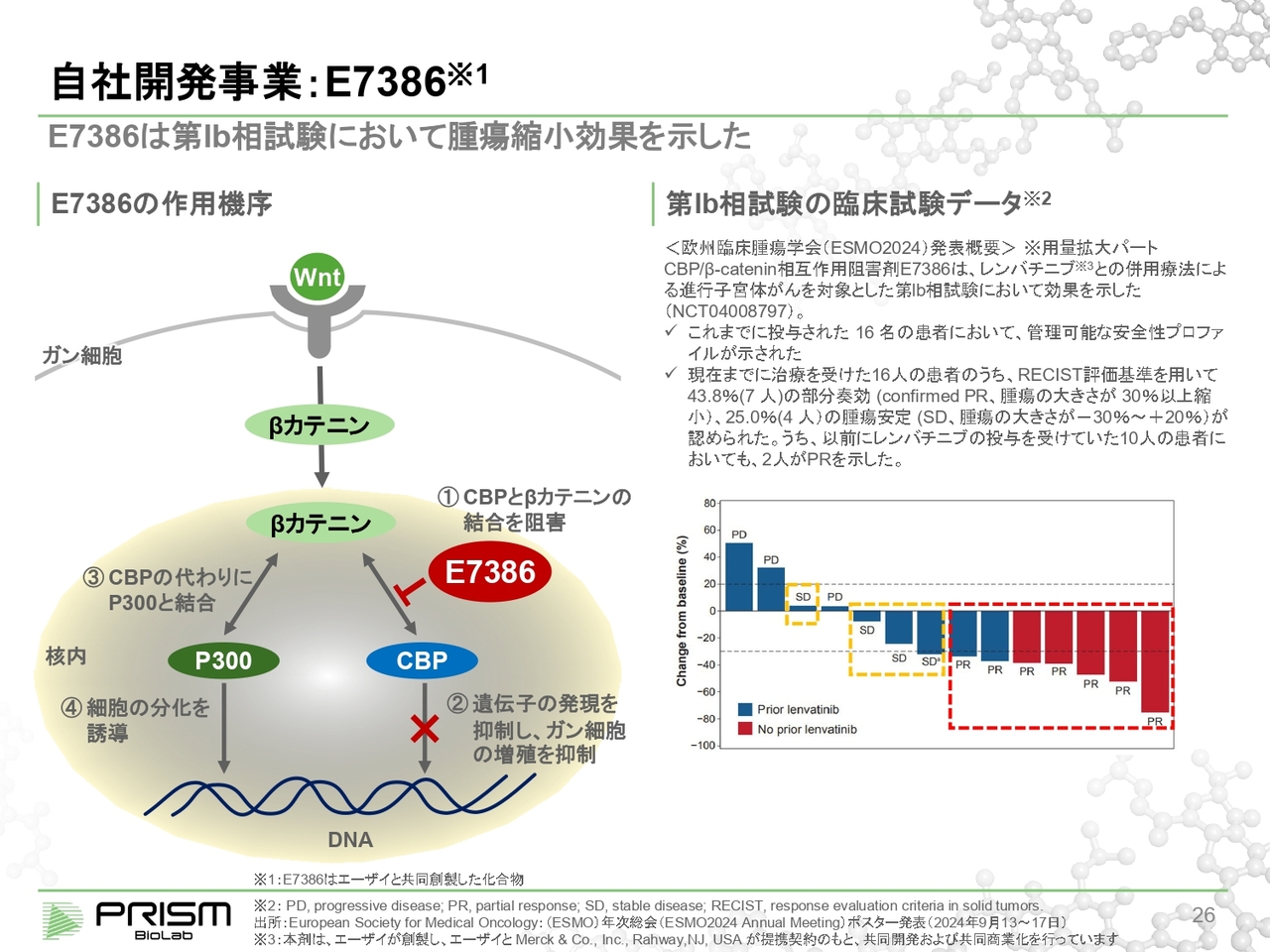
スライドに記載の「E7386」は、エーザイとの共同開発になります。「Wnt pathway」は、がんに深く関与していることが昔から知られており、これを止めることによってがんを止めるという臨床試験がたくさん行われてきましたが、すべて毒性の問題でストップしています。
我々の化合物は、この「Wnt pathway」の下流で細胞の中に入り、βカテニンというタンパク質がCBPという別のタンパクとくっつくことによって増殖するのを、CBPにくっつくことで止めます。実はこのβカテニンは、CBPとよく似ていますが少し違うタンパク質のP300にもくっつき、細胞を分化させます。がんは増殖ばかりしてしまう病気ですので、これを分化に変えるということは、がんではなくなるということになります。したがって、このようにスイッチを切り替えるということになります。
これにより、「Wnt pathway」全体を止めないということで、毒性が十分にコントロールでき、開発が進んでいます。
スライド右側は、現在エーザイのほうで進めていただいている「レンバチニブ」という抗がん剤との併用試験について、今年9月に開催された「欧州臨床腫瘍学会(ESMO 2024)」での中間発表の際のデータになります。
16名の患者のうち、7名がPR(Partial Response)という、がんが有意に小さくなったという結果が出ています。SD(Stable Disease)という、がんが悪化しない方も含めると約7割近い効果が確認されています。
自社開発事業: PRI-724
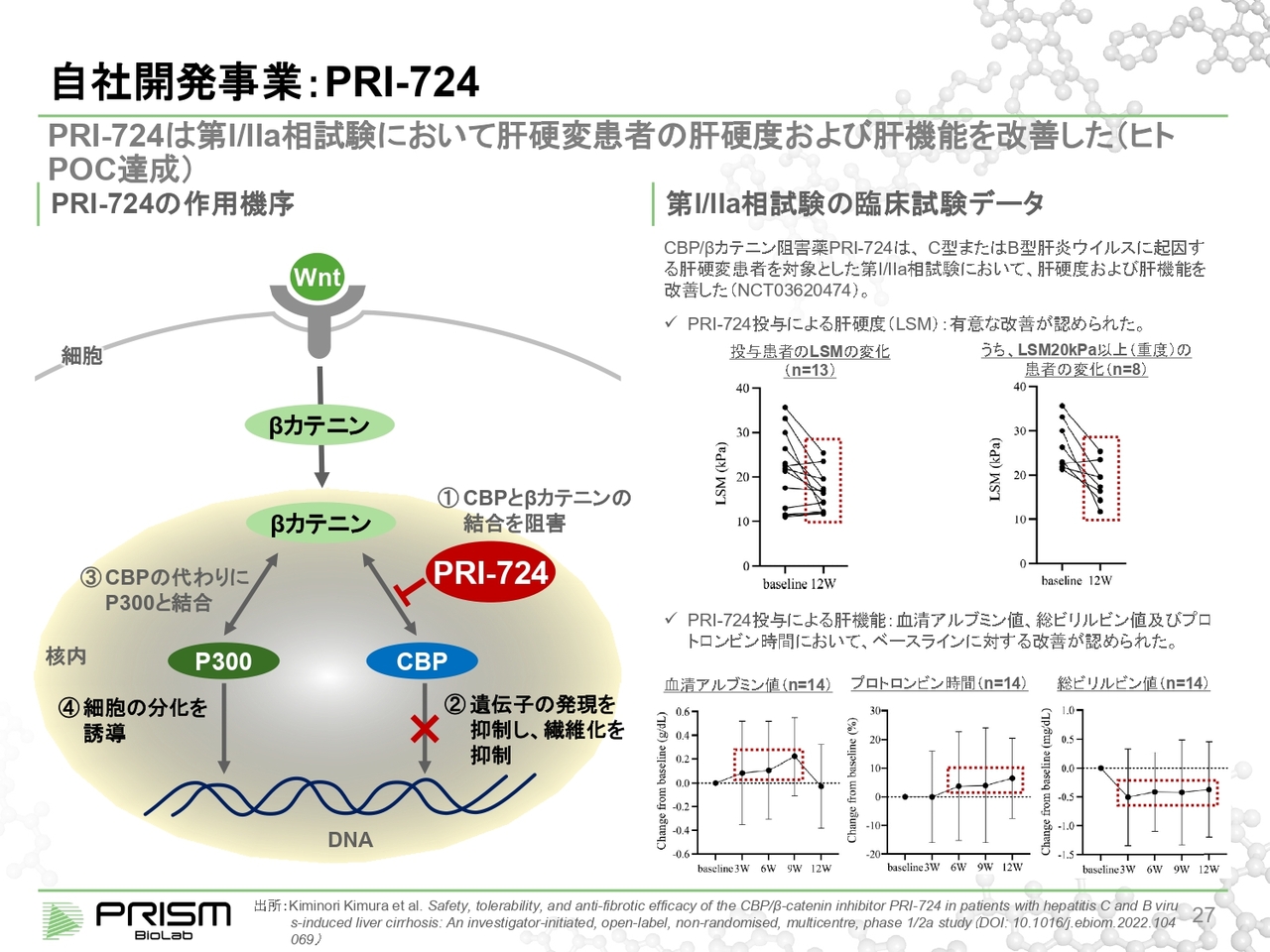
また、「Wnt pathway」は線維症にも重要な役割を果たすことが知られています。スライドに記載のある「PRI-724」は、大原薬品工業にライセンスアウトしている化合物ですが、こちらも同様にCBPと結合することによって線維化を抑制しています。
こちらは肝硬変において臨床試験を実施しています。肝硬変とは、肝臓が線維化して硬くなってしまう病気です。
LSM(Liver stiffness measurement)という肝臓の硬さである、肝硬度を測る指標があります。スライド右側の図にあるとおり、本来は10以下が健康なのですが、30まで上がっている患者に対して、12週間、約3ヶ月間投与したところ、肝臓がかなり柔らかくなっています。すなわち、線維化がもとに戻る傾向があることを示しています。
また肝機能も改善しており、今まで肝硬変は一定以上進むと治らない病気とされていましたが、それを治療する薬として期待されています。
開発プロセスのイメージ:自社開発事業
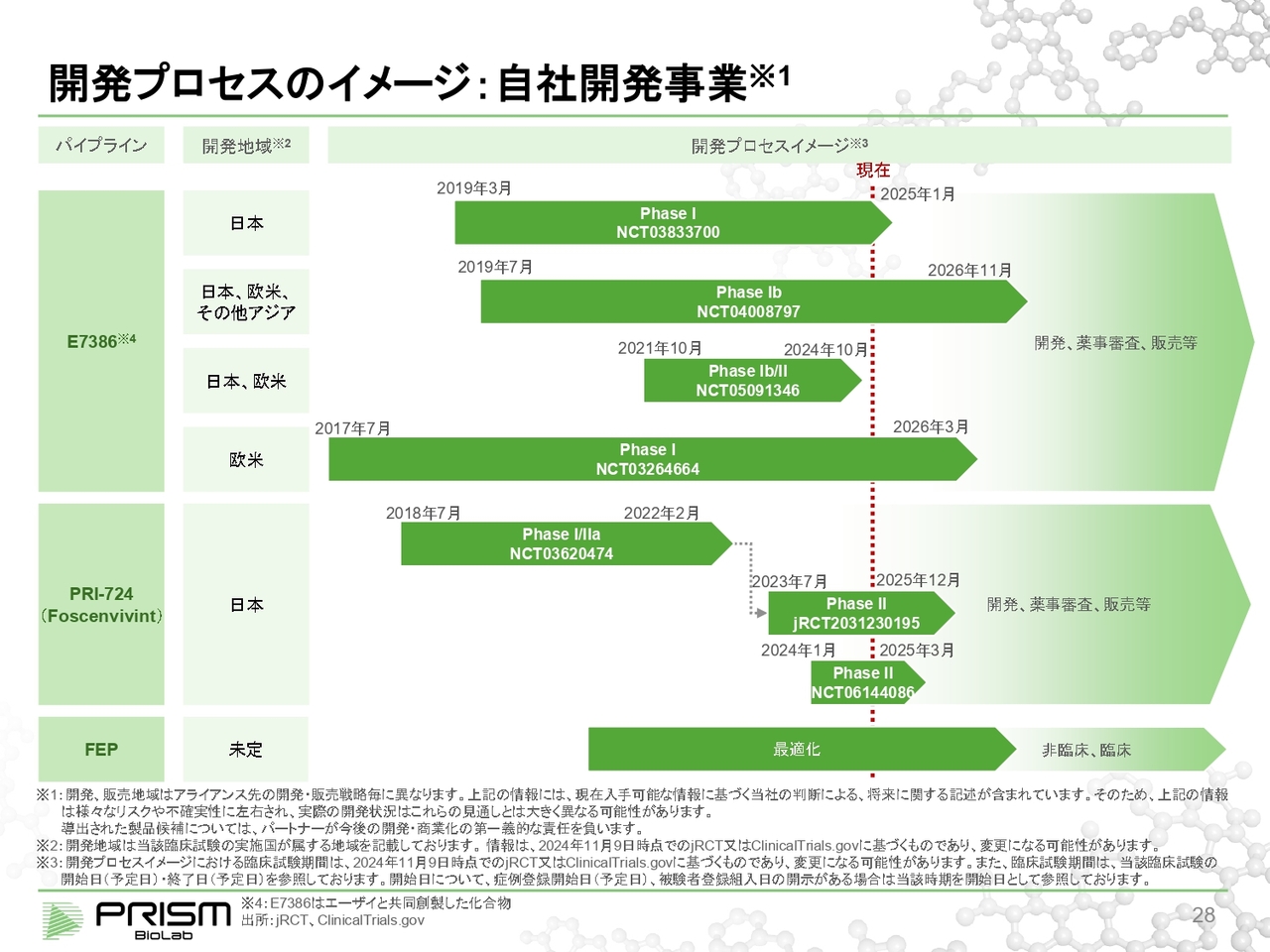
スライドはそれぞれのプログラムにおける臨床試験の進捗状況です。それぞれ順調に進捗しています。
共同開発事業:創薬共同研究

共同開発事業では、現在7社のグローバル大手を含めた製薬会社と、さまざまな標的に対して研究を進めています。それぞれの会社との秘密保持契約などの関係から、具体的なお話ができない状況ではありますが、後ほど、今後どのようなかたちで進捗を示すかについてご説明したいと思います。
事業進捗を示す指標:段階別プログラム数の推移
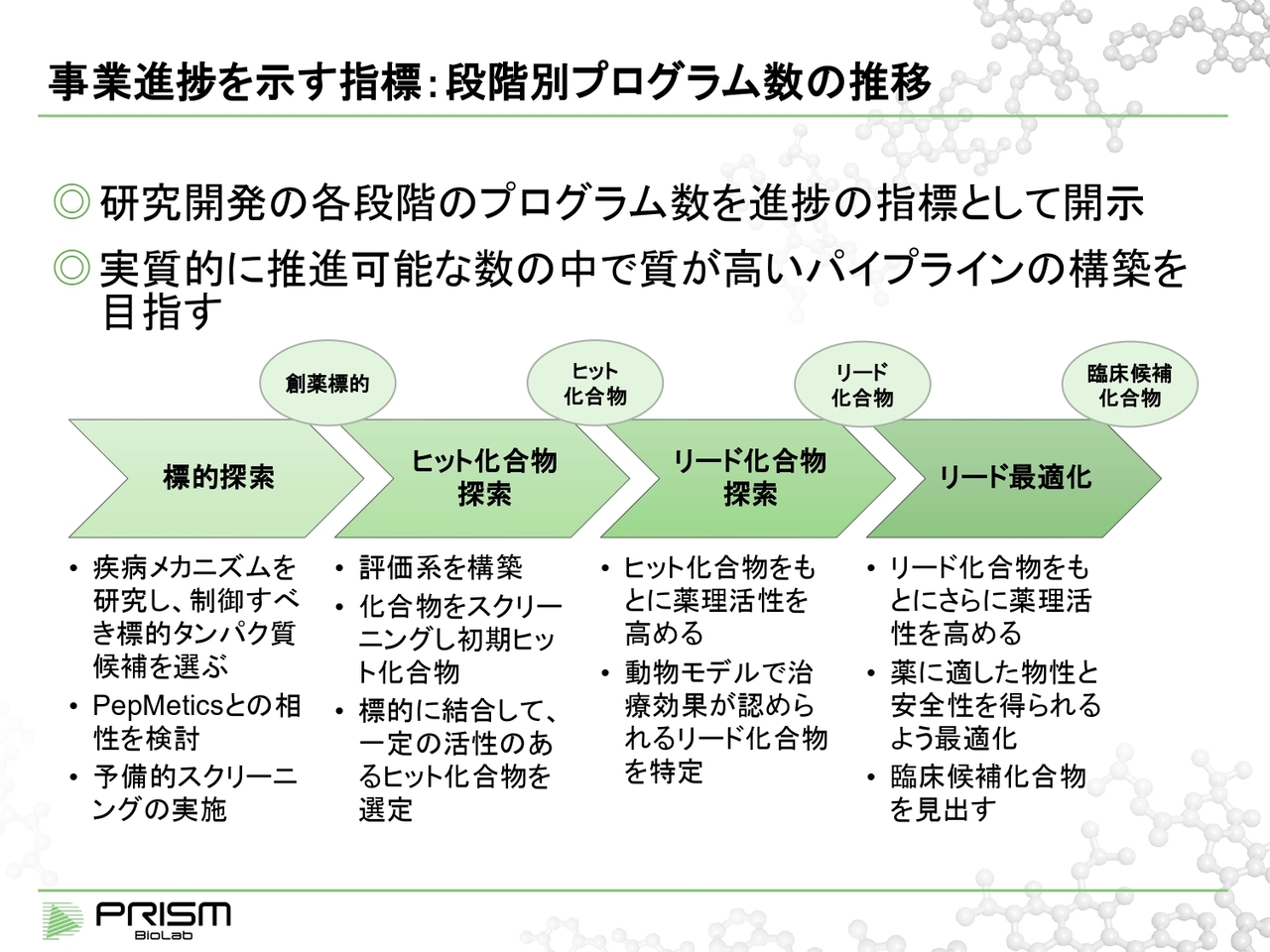
成長戦略です。先ほどお話しした当社のプログラムの進捗を、今後どのようなかたちで示していくかについてご説明します。
当社ではまず創薬の標的を探索し、ヒット化合物を作り、リード化合物を作り、そして薬のもととなる臨床候補化合物を作っていきます。これは業界全体の一般的な整理の仕方になりますが、当社もこのようなかたちで整理しています。
各段階で、いくつのプログラムがあるかということを、きっちりとバランスよく作っていくことが健全な研究開発の管理体制であると思っています。
ただ、数が多ければよいのかというと、そうではありません。組織には一定のリソースがあります。我々はバイオベンチャーのため、多くのプログラムを同時に進めると、その分リソースが分散してしまいます。
そのため、むしろ本当に必要なプログラムや質の高いプログラム、可能性の高いプログラムに絞り込んで、そこに集中的に投資していくことが重要であると考えています。
それぞれの段階で、質の高いパイプラインがどれだけあるかということを大変重要に考えています。
自社開発事業
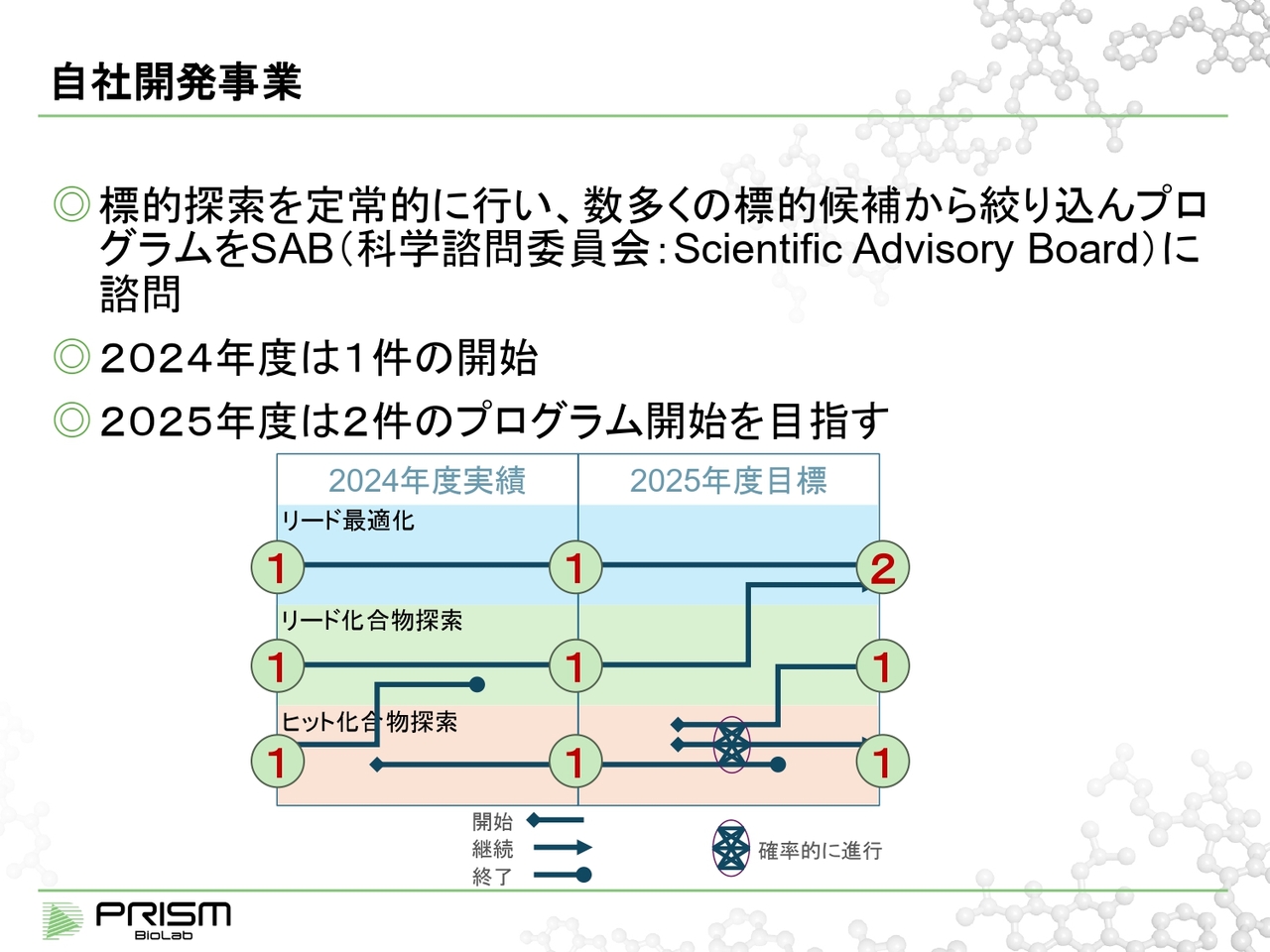
当社では、まず始める前に標的探索を定常的にルーチンで行っています。何十件、何百件という候補の中から絞り込み、最終的にそれを科学諮問委員会(SAB)にかけ、それからスタートさせています。
2024年度は1件がスタートしています。スライド図にあるように、ヒット化合物探索の段階で1つのヒット化合物が見つかり、リード化合物探索の段階に進んでいましたが、こちらは中止しています。
先ほどお話ししたように、なかなか想定どおりに進まないものについては、一定の段階で適切に判断して、可能性が低くなってきたものに対しては長く投資をしないということも重要なことだと考えています。
そのようなことから、当期が始まる前は各段階で①であったものが、現状はそれぞれ中身がより改善していると考えています。
2025年度の目標としては、ヒット化合物探索を新たに2件開始し、最終的には図の右端に示すように、上部からそれぞれ②、①、①というかたちに持っていきたいと考えています。
共同開発プロジェクト
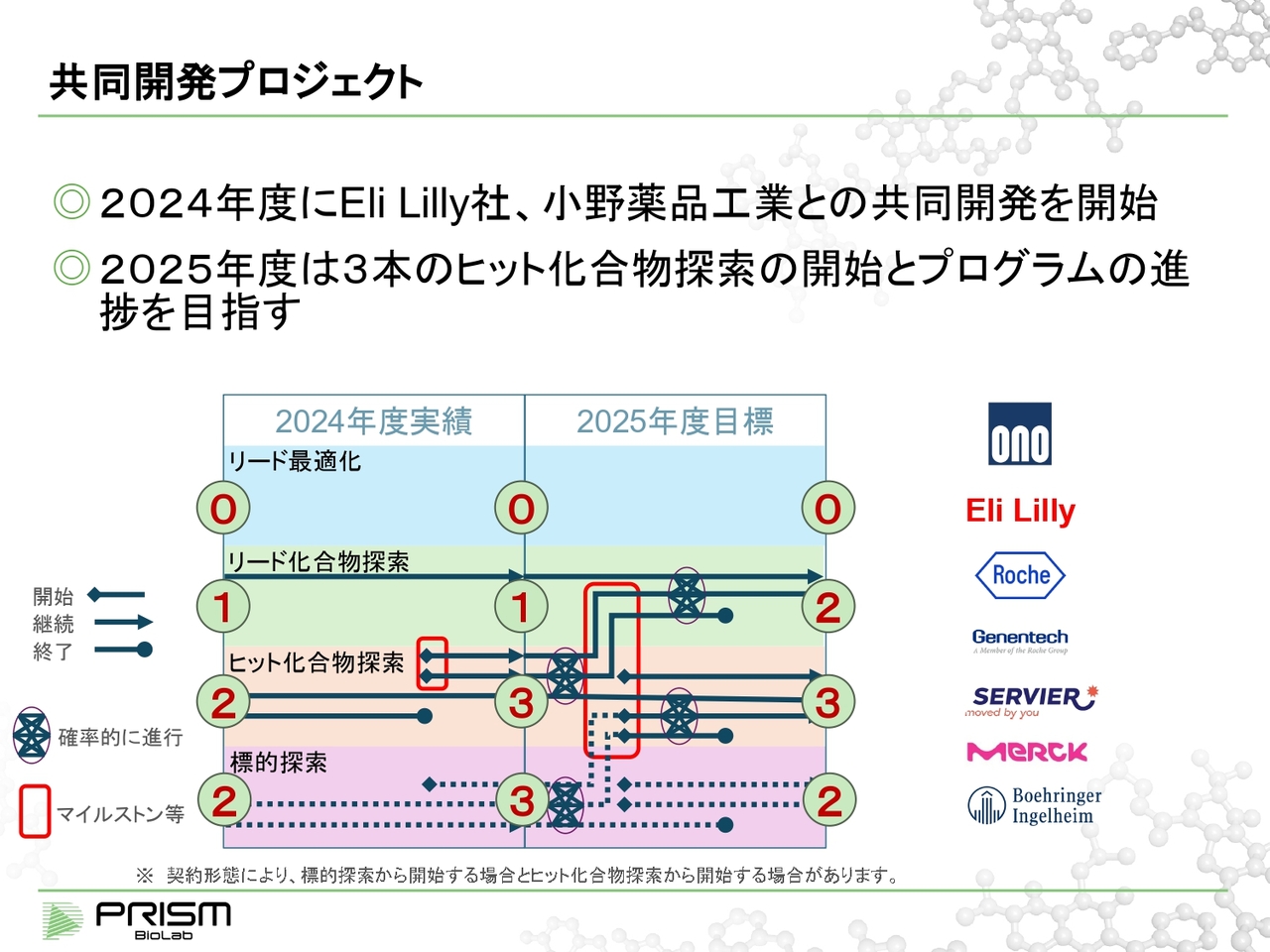
続いて共同開発プロジェクトについてご説明します。共同開発プロジェクトの場合、個々のパートナーとのプログラムについて詳細にご説明するのは、秘密保持上なかなか難しい部分があります。
当社は数多くのパートナーさまとコラボレーションさせていただいていますので、会社を特定できないかたちで、全体の数からどれだけ進捗しているのかについて、今後はお示しできればと思っています。
2024年度にはLilly社、小野薬品工業との共同開発を開始しました。それにより、スライド図の中央に示すとおり、各段階上部から①、③、③というかたちで進捗しています。
2025年度については、スライドは目標値になりますが、できれば3本のヒット化合物探索を始めて、そのほかも進捗させることで、最終的には②、③、②というバランスに持っていきたいと思っています。
図の赤で囲んだ部分は、きちんとヒットが見つかったり、さらに新しく始めることで、なんらかのアップフロントやマイルストンのイベントになっていきます。
創薬基盤の継続的な進化
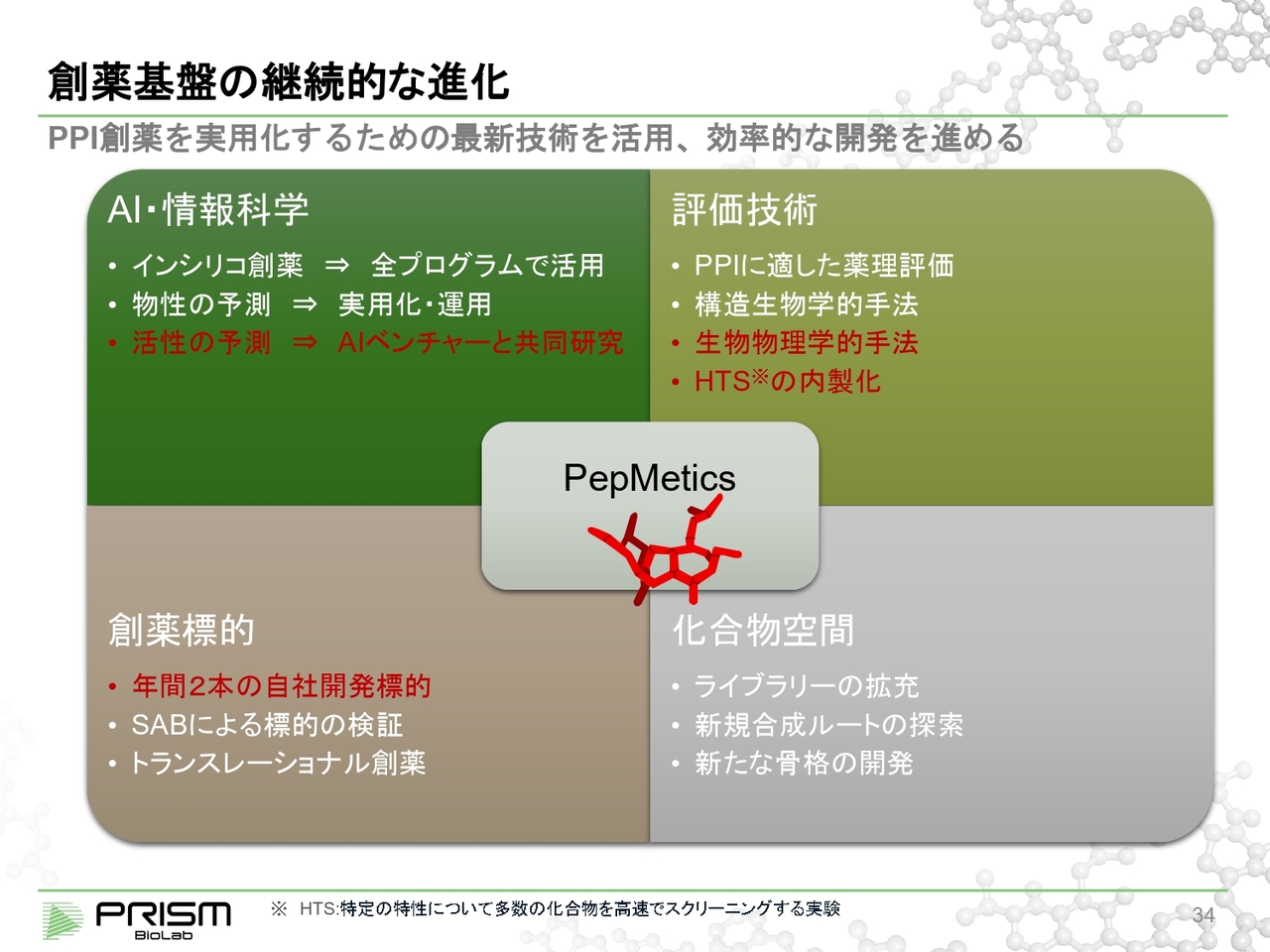
「PepMetics」の技術をより一層高めて、創薬の成功確率を高めていくことも重要です。そのためさまざまな基盤、技術に対する投資も行っています。
中でもAI・情報科学については大変重視しており、白字で記載しているものはすでに実施しているところで、赤字は今期に重点的に発展させたいところです。
インシリコ創薬では、コンピューターを使ったものは当然活用しており、またAIによる物性予測については実用化の段階で、すでに実験現場レベルで運用に入っています。
今後は活性の予測をしていきます。これはAIベンチャーなどさまざまなところと共同研究しながら進めていきたいと思っています。
さらに評価技術、バイオロジーについてもPPIにより適したものを選んでいこうというものです。生物物理学的手法については、どのように結合しているのかという構造を、エックス線やクライオ電顕などを使いながら分析する方法も、自社内にそのような優秀な方をそろえて行っていこうと考えています。
HTS(ハイ・スループット・スクリーニング)については、自社のライブラリを外に出すのではなく、自社の実験室の中で全部スクリーニングができるような内製化も考えています。
創薬標的については、引き続き年間2本の自社開発の標的を作り出していくことを目標に掲げています。継続的に化合物空間も広げていっています。
創薬業界のパラダイムシフト

歴史的に、創薬業界は新しい技術ができると階段的に大きな飛躍を遂げます。例えば、かなり昔の話になりますが、有効成分を単離したのはモルヒネが初めてで、それによりさまざまな単離した薬ができました。さらにそれを合成できるようになり、20世紀は低分子の時代といわれました。
さらに、バイオ医薬品が1980年代から出てきて、これが今大変大きな市場になっています。そのほか分子標的薬もあり、最近でいうとmRNAも大きな創薬領域になると思います。
我々は、低分子による細胞内のPPIという、今まで創薬としては難しいと言われるものにおいて、新たなパラダイムを作り出していきたいと考えています。
質疑応答:足元での課題について
司会者:「足元でのPRISM Bioの最大の課題は何でしょうか?」というご質問です。
竹原:先ほどもお話ししたように、我々はかなり多くのパートナーとの提携をしており、さらに自社でのプログラムも並行して進めています。
この成長のために、何がボトルネックになるかというと、人材です。そのため採用は極めて重要な話になるのですが、おかげさまで、昨年あたりからいろいろな実績が出るにつれて、日本でも本当に優秀な方々にたくさん集まっていただけるようになってきました。
とはいえ、まだ我々が手掛けたいプログラムの数のほうが多い状況で、今後、そのような優秀な方々をどれだけ採用していけるかということが1つの課題だと思っています。
質疑応答:競合他社について
司会者:「類似の研究を行っている他社は世界的にどのような会社がありますか?」というご質問です。
竹原:我々もいろいろと探してはいるのですが、今同じように、例えば低分子においてPPIの制御を行っている会社は比較的少ないです。
先ほど入りにくいとお伝えしたペプチドや少し大きめの分子などで細胞の中のPPIを狙い、ペプチドをどうにか細胞膜を通過させるような技術を開発して、同じような標的を狙っているところはいくつかあります。
そのようなところと直接競合するかというと、ペプチドのほうが制御しやすいPPIと、我々のヘリックスのように、ポケットにきれいに低分子がはまることで制御しやすいPPIもあり、多少その標的の種類は変わってくるかと思います。
そのため、直接競合するというよりも、標的によってどちらが有利になるかが変わってくるかと思います。
質疑応答:マイルストン受領の発生について
司会者:「プロジェクトの指標など、大変わかりやすかったです。今後も定期的なアップデートをお願いします。共同開発プロジェクトではヒットからリードに移行するものがありましたが、こちらはマイルストン受領が発生しますか?」というご質問です。
竹原:契約によっていろいろなパターンがあります。先ほどご説明したステップの中で、ヒット化合物が見つかった段階でマイルストンが入るものと、リード化合物が見つかった段階でまとまったかたちでマイルストンが入るというパターンがあり、それぞれ契約次第になります。
我々としては、できる限り小まめにもらったほうがいいため、それぞれの段階でもらえるような契約を結ぶように心掛けています。
今期は、現状3つのプログラムでヒット化合物探索をしており、できれば今期中に少なくとも1つ、できれば2つぐらいを上に上げていきたいと思っています。その中でマイルストンが発生するものもあります。
また、こちらの新たなヒット化合物探索を始めるというところで、基本的にアップフロントもしくはマイルストンが発生する契約になっています。
この中で、どれだけみなさま方にリリースできるかというのも契約によって制限が変わっていくため、我々としてはできる限りみなさまに開示できるような働きかけをしています。
質疑応答:新規提携の可能性について
司会者:「2025年9月期も同様に新規提携などの可能性はあるのでしょうか? キャパシティ的に難しいということもあるのでしょうか?」
竹原:2025年9月期も、できれば新しい契約をスタートしたいと思っており、いくつかお話を始めています。
またキャパシティについては、先ほどお話ししたように人材の確保を含めてキャパシティの増大に努めており、それができる限り律速段階にならないように経営努力しています。
竹原氏からのご挨拶
以上をもちまして、株式会社PRISM BioLab 2024年9月期の決算説明会を終了します。
みなさまのご期待に添えるように、グローバルに存在感のあるバイオベンチャーに育っていきたいと思っています。
引き続きご理解とご支援のほど、どうぞよろしくお願いします。本日はどうもありがとうございました。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
206A
|
194.0
(10:25)
|
+13.0
(+7.18%)
|
関連銘柄の最新ニュース
-
PRISMバ、10-12月期(1Q)経常は赤字拡大で着地 02/13 16:30
-
PRISMバ(206A) [Summary] Non-consol... 02/13 16:30
-
PRISMバ(206A) 2026年9月期第1四半期決算短信〔日本... 02/13 16:30
-
PRISMバ(206A) 営業外収益及び特別損失の計上に関するお知らせ 02/13 16:30
-
PRISMバ(206A) PRISM BioLabとエーザイが共同... 01/21 16:00
新着ニュース
新着ニュース一覧-
今日 10:45
-
今日 10:42
-
-
今日 10:38

