【QAあり】Delta-Fly Pharma、新株予約権行使で4.4億円を資金調達 国内30施設で肺がん治療薬の臨床試験実施、研究を加速
2025年3月期 第2四半期決算の概略
黒滝健一氏(以下、黒滝):Delta-Fly Pharma株式会社取締役管理部門担当の黒滝です。よろしくお願いします。2025年3月期第2四半期の決算概要をご説明します。
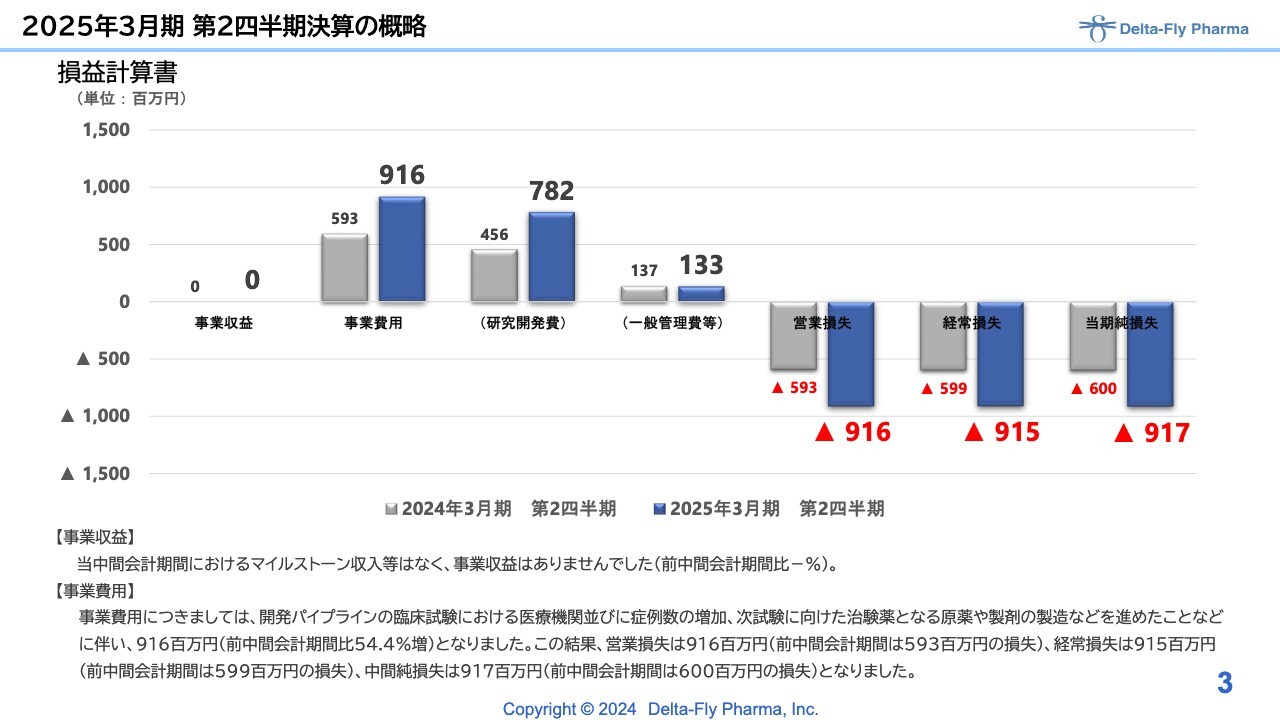
はじめに損益計算書です。当中間期の事業収益はありませんでした。事業費用は9億1,600万円で、内訳としては、研究開発費で7億8,200万円、一般管理費で1億3,300万円となっています。営業損失、経常損失、当期純損失はいずれも9億1,000万円強で着地しています。
2025年3月期 第2四半期決算の概略
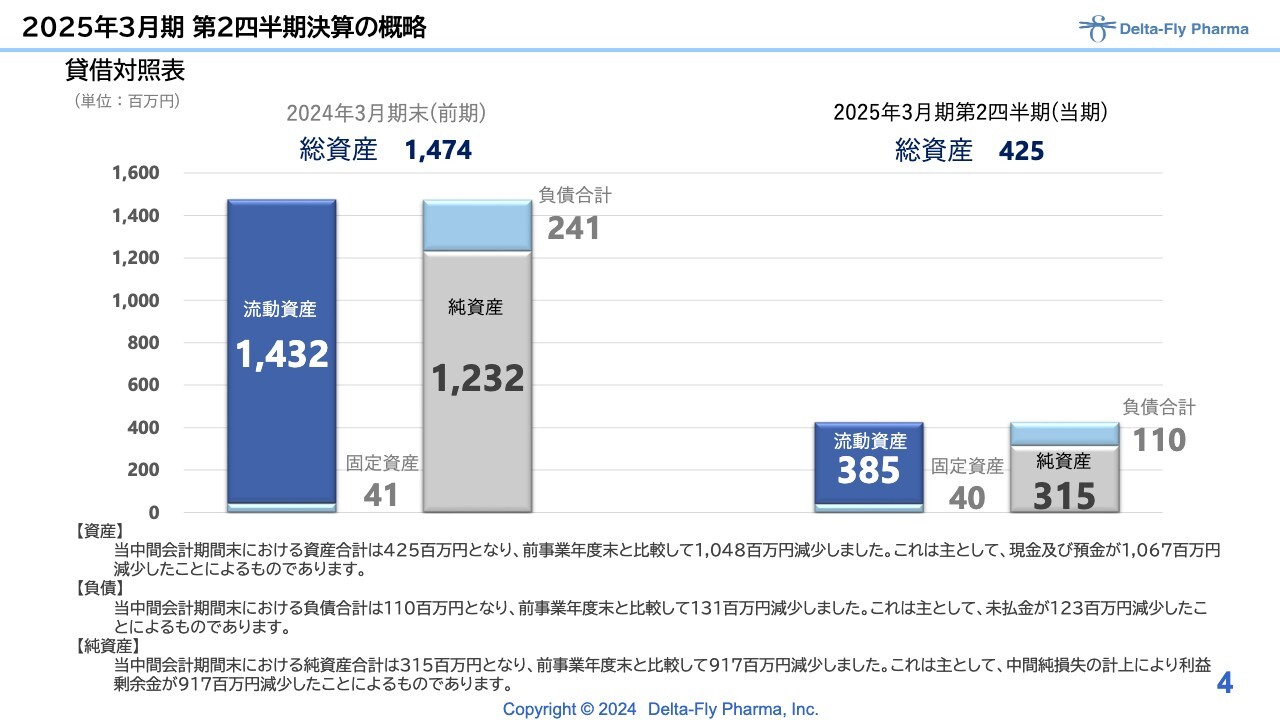
貸借対照表です。前期末総資産は14億7,400万円でしたが、この半年で10億円強の費用を使い、現預金が10億6,700万円ほど減少しています。営業損失、経常損失等の計上により利益剰余金が減少し、純資産も減っています。
2025年3月期 第2四半期決算の後発事象について
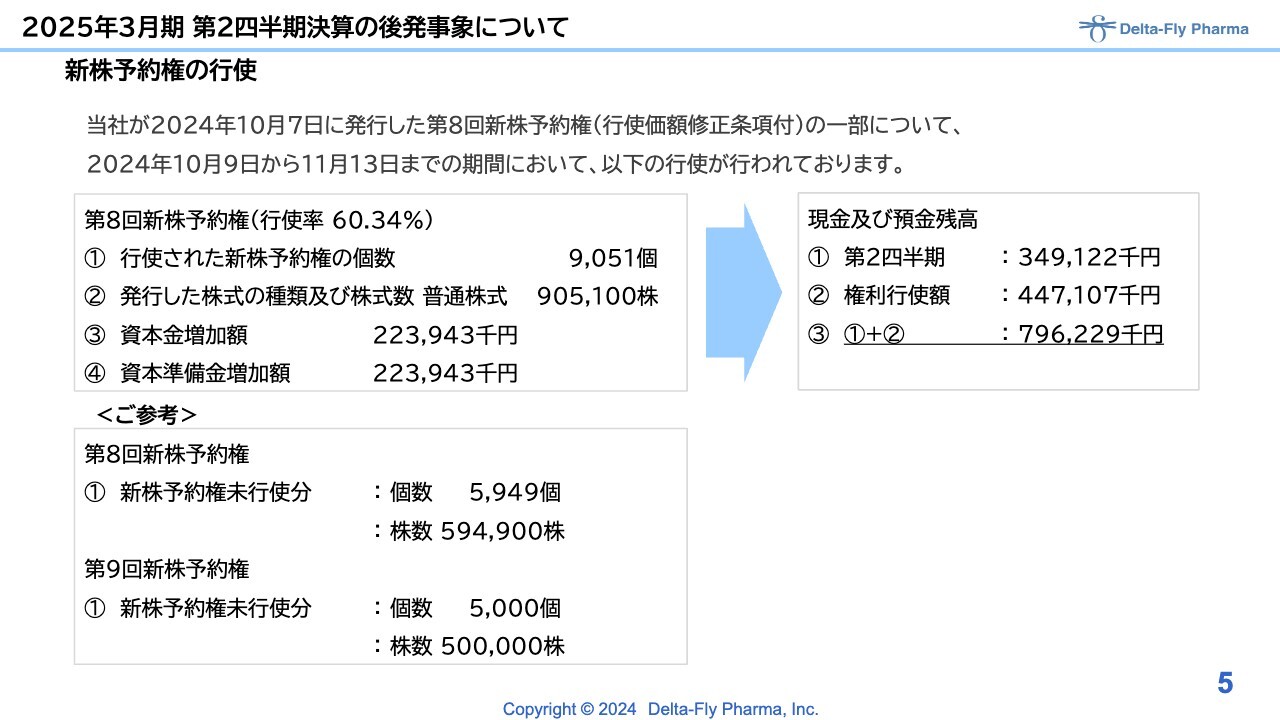
今回の決算短信ならびに半期報告書の後発事象に記載していますが、9月20日に新株予約権の発行決議を行いました。10月7日に効力発生し、付与しています。
権利行使開始日は10月8日で、9日に最初の権利行使が始まり、13日までに約6割の権利行使が実施されました。権利行使で調達した金額が4億4,700万円強となり、第2四半期の現預金残高と合わせ、現在約8億円の手元流動資産がある状況です。
また、未行使分については、第8回で約6,000個、第9回の固定で5,000個が残っており、今後新たに権利行使が進めば、現預金の調達で増えていく状況となっています。
事業計画(2025年3月期予想)
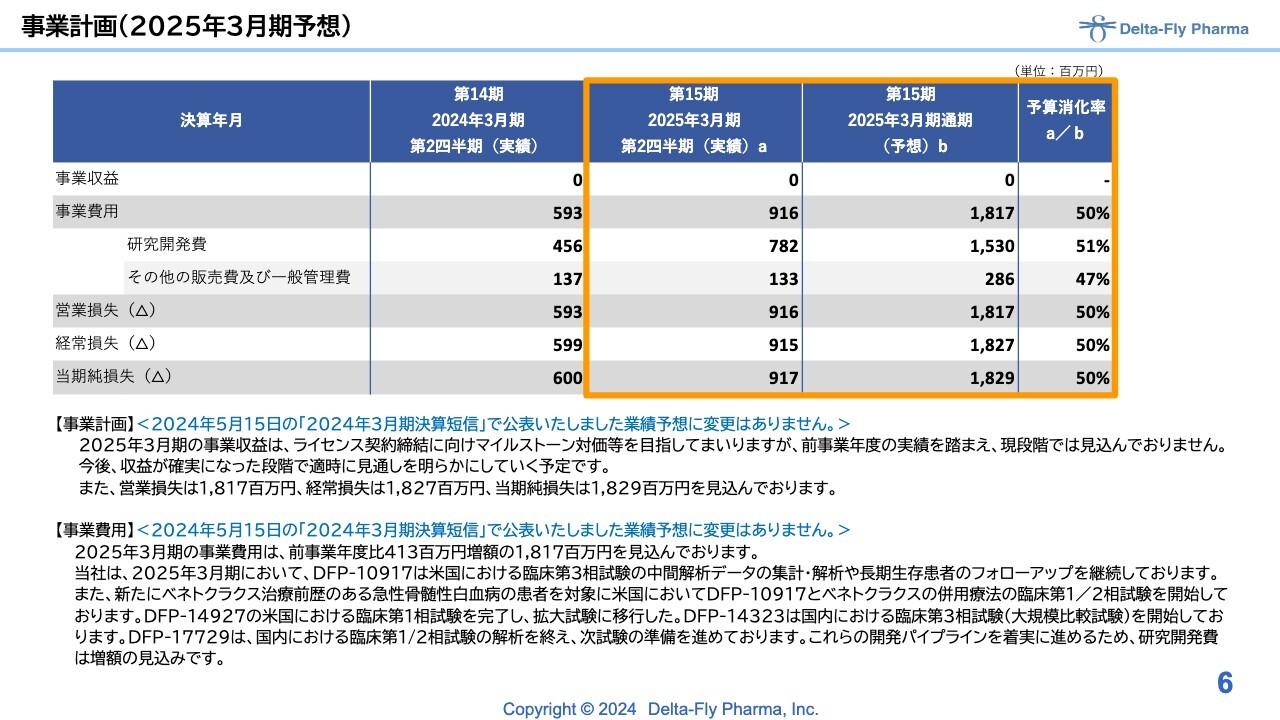
当期の事業計画です。5月の前期決算短信発表で公表した業績予想については変更ありません。当初の計画に対して、第2四半期実績の予算消化率はちょうど半分程度となり、足元の研究開発も含めて計画どおり進んでいます。
資金調達の目的と資金使途

資金調達の新株予約権については、スライド8ページ以降に概要を記載していますのでご確認ください。
主な資金使途としては、「DFP-10917」と「ベネトクラクス(VEN)」の併用に関する新しい研究開発費、現在第3相試験の最終局面を迎えている「DFP-10917」単剤の承認までの関連費用、アメリカで行われている「DFP-14927」の第1相拡大試験の研究開発費用に使い、残りは開発体制・管理体制の強化および特許関連費用で3億円程度を見込んでいます。
本新株予約権の概要
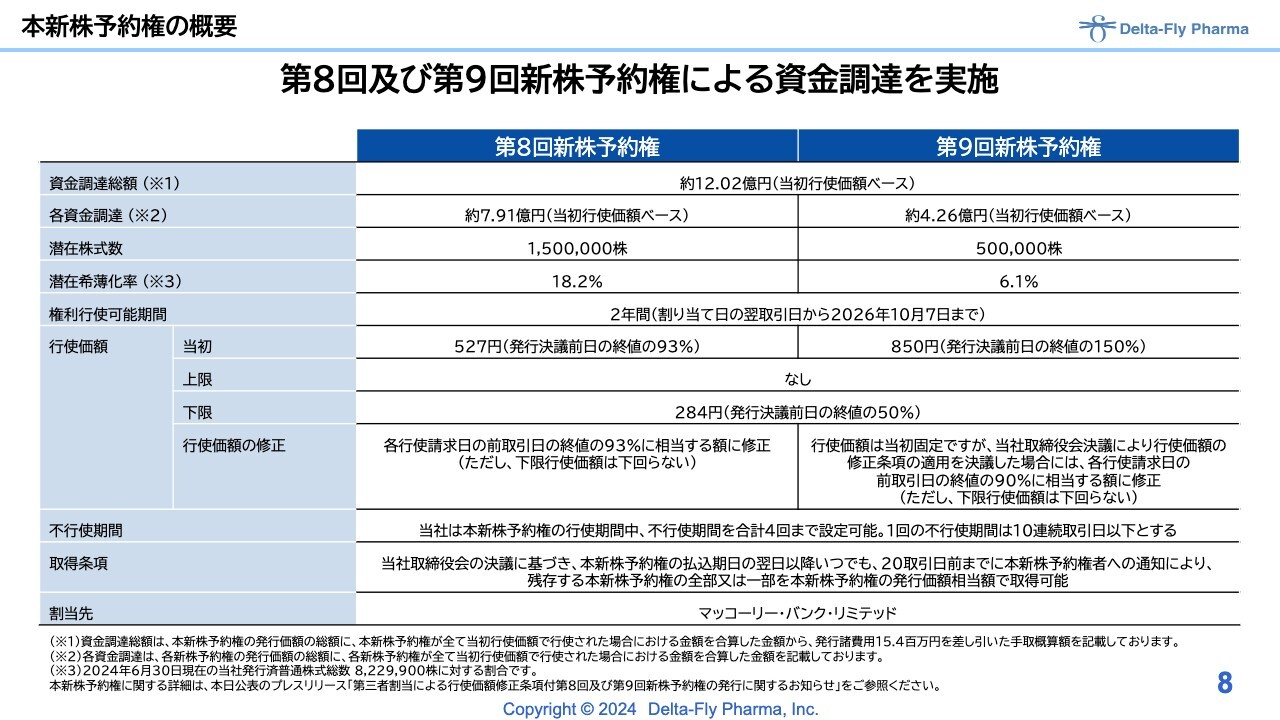
新株予約権の概要はスライドのとおりです。
本新株予約権に関する背景と目的、及び本新株予約権の特徴

新株予約権に関する背景と目的、及び新株予約権の特徴です。
現時点における調達資金の充当状況
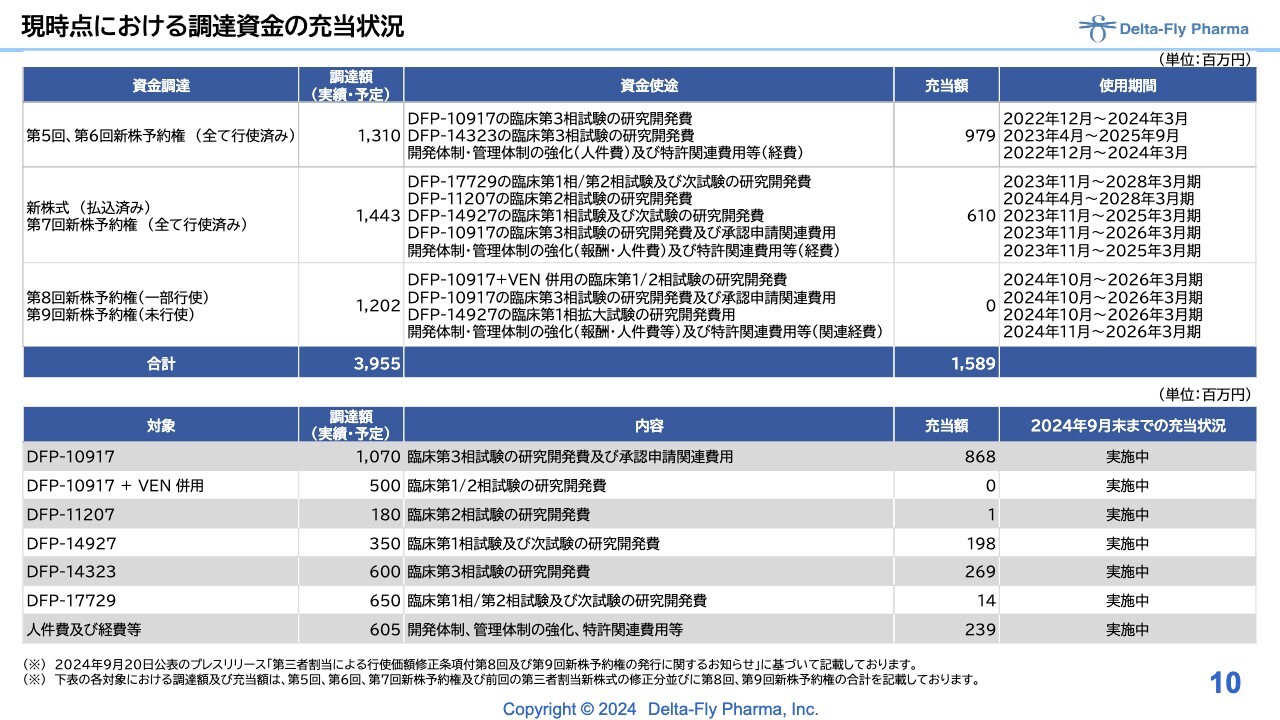
過去の調達資金も合わせて、充当状況を示しています。現在の進捗状況をご確認いただければと思います。
今後のスケジュール
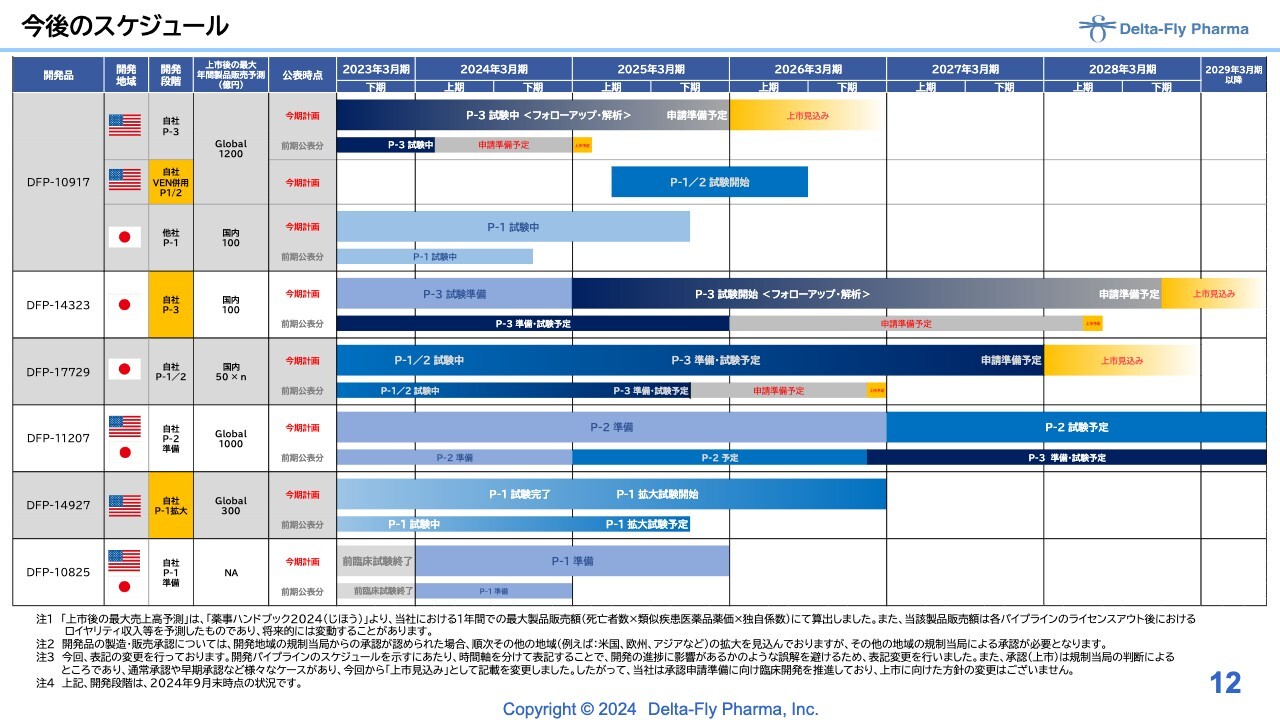
江島淸氏(以下、江島):代表取締役社長の江島です。開発パイプラインの状況についてご説明します。
今後のスケジュールについてはスライドのとおりです。みなさまから多大な関心を寄せられている「DFP-10917」も、臨床第1相試験/臨床第2相試験の併用試験はおおむね順調です。
ただし、早くなるか遅くなるかについては試験を行ってみなければわからないため、計画自体は大きく変えていません。
「DFP-14323」以下については後ほど詳細をご説明します。ここでは全体の進捗状況をご理解いただければと思います。
開発パイプラインの状況と今後のスケジュールの概要
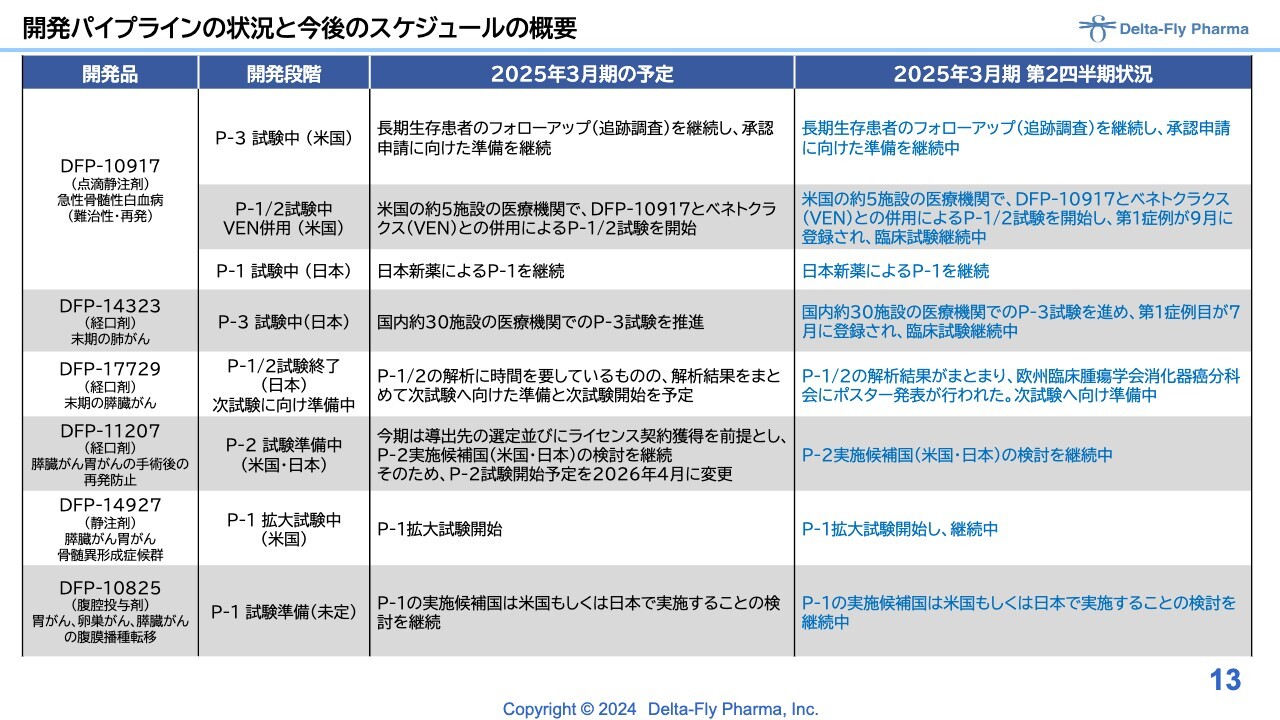
それぞれの品目のアップデートの現状です。「DFP-10917」については、長期生存者のフォローアップを継続しています。先般プレスリリースで発表した内容については後ほどご説明しますが、併用については臨床第1相試験/臨床第2相試験の第1相試験部分が順調に進んでいます。日本国内においては、日本新薬が日本国内で単剤の臨床第1相試験を継続しています。
「DFP-14323」については、先般プレスリリースで発表したとおり、日本国内30施設の医療機関で臨床第3相試験を進めており、第1症例目が7月に登録され、その後も臨床試験を継続中です。
「DFP-17729」については、臨床第1相試験/臨床第2相試験の解析結果がまとまり、欧州臨床腫瘍学会消化器がん分科会で発表しました。国内でも別途発表していますが、次試験をどのような内容で行うかについては、PMDAと協議を始める予定です。
「DFP-11207」については、米国で臨床第1相試験を終えていますが、臨床第2相試験は、新型コロナウイルスの影響もあり、米国と日本、もしくは日本に集約して実施する計画を検討中です。
「DFP-14927」については、臨床第1相試験の拡大試験を開始しています。
「DFP-10825」については、新型コロナウイルスの影響で動物実験用のサルの調達が困難となっていましたが、ようやく臨床第1相試験に入れるデータが揃い、現在準備中です。
研究開発 〜DFP-10917

それぞれの品目の研究開発状況はスライドのとおりです。「DFP-10917」については、急性骨髄性白血病の末期の患者さまに対し、スライドに示した内容で開発が進んでいます。
DFP-10917 〜米国における急性骨髄性白血病の状況
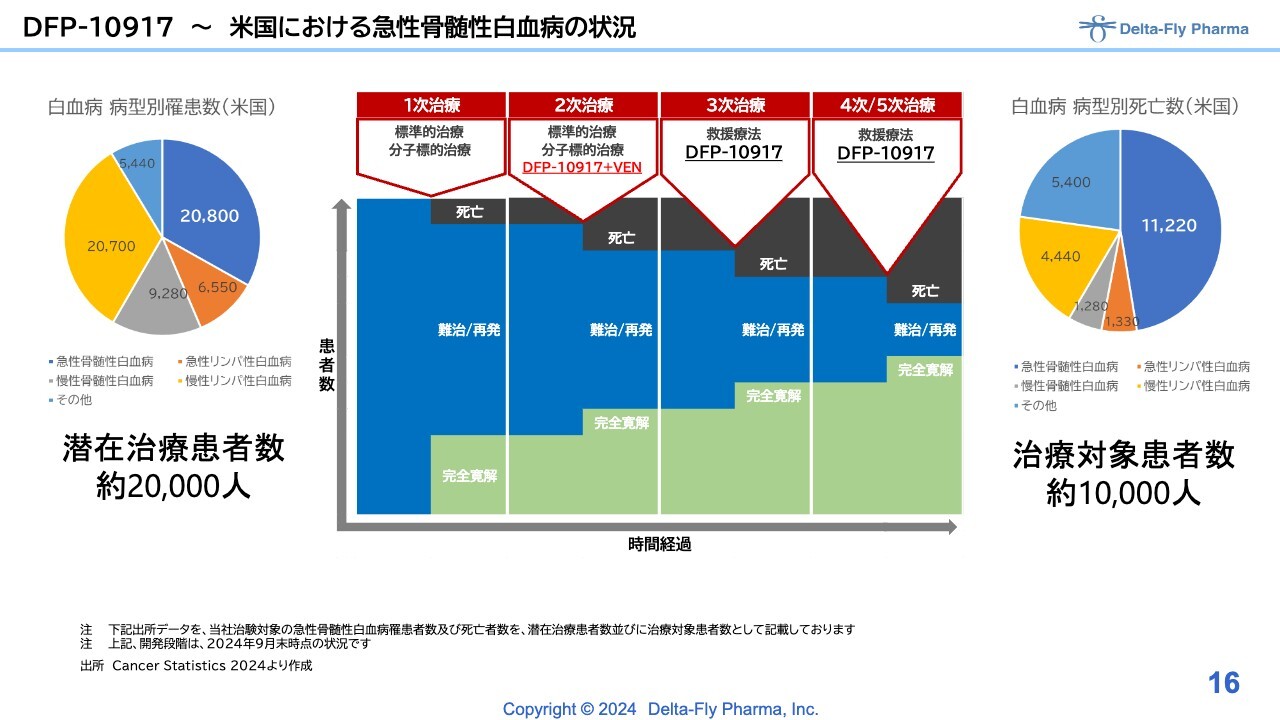
「DFP-10917」単剤の試験は、3次治療以降の患者さまを対象に開発を進めており、製造販売が成立する暁にはスライド図のような状況になります。
「DFP-10917」と「ベネトクラクス」の併用は2次治療以降ということで、市場が大きく反映するようなバックグラウンドが構築できればと考えています。
研究開発〜DFP-10917とベネトクラクス(VEN)との併用臨床第1/2相試験

「ベネトクラクス」は、すでに米国では急性骨髄性白血病の患者さまを対象に、単剤ではなく「アザシチジン」等との併用で承認されています。
「DFP-10917」と「ベネトクラクス」を早く実施しようということになった背景については、スライドに青文字で記載のとおり、併用が承認されてはいるものの、臨床的に副作用の面等で非常に使いにくいということで、こちらを凌駕できるような併用療法を実施し、将来に備えようということで開発を進めています。
DFP-10917の臨床第3相比較試験の症例登録完了に関するお知らせ
9月10日付で発表した、「DFP-10917」の臨床第1相試験/臨床第2相試験の症例登録開始に関するプレスリリースです。
DFP-10917の臨床第3相比較試験の症例登録完了に関するお知らせ

臨床第1相試験/臨床第2相試験の最初の症例が順調に進み始めたということで、10月28日付でみなさまにお知らせした次第です。
単剤については患者数が減少してきたため、全生存期間の解析に係るデータカットオフを行うための作業を始める予定としています。
データカットオフがいつになるかについては、私どもがデータカットオフをしてほしいと委託会社に頼み、彼らにデータをまとめてもらい、最終的に独立委員会が判断するため、かなりの時間がかかるということをご理解いただければと思います。
研究開発〜DFP-14323
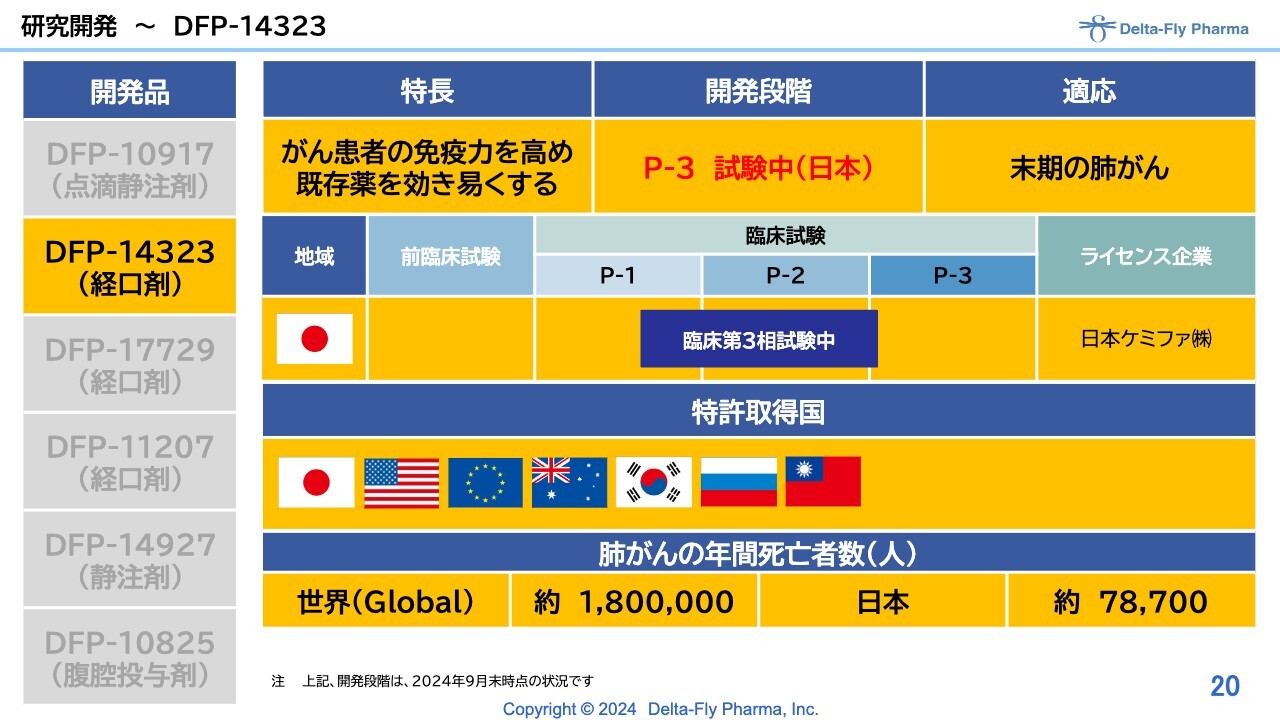
「DFP-14323」については、日本国内で臨床第3相試験を実施中です。末期の肺がん患者さまが対象となります。
研究開発〜DFP-14323 臨床第3試験の施設紹介
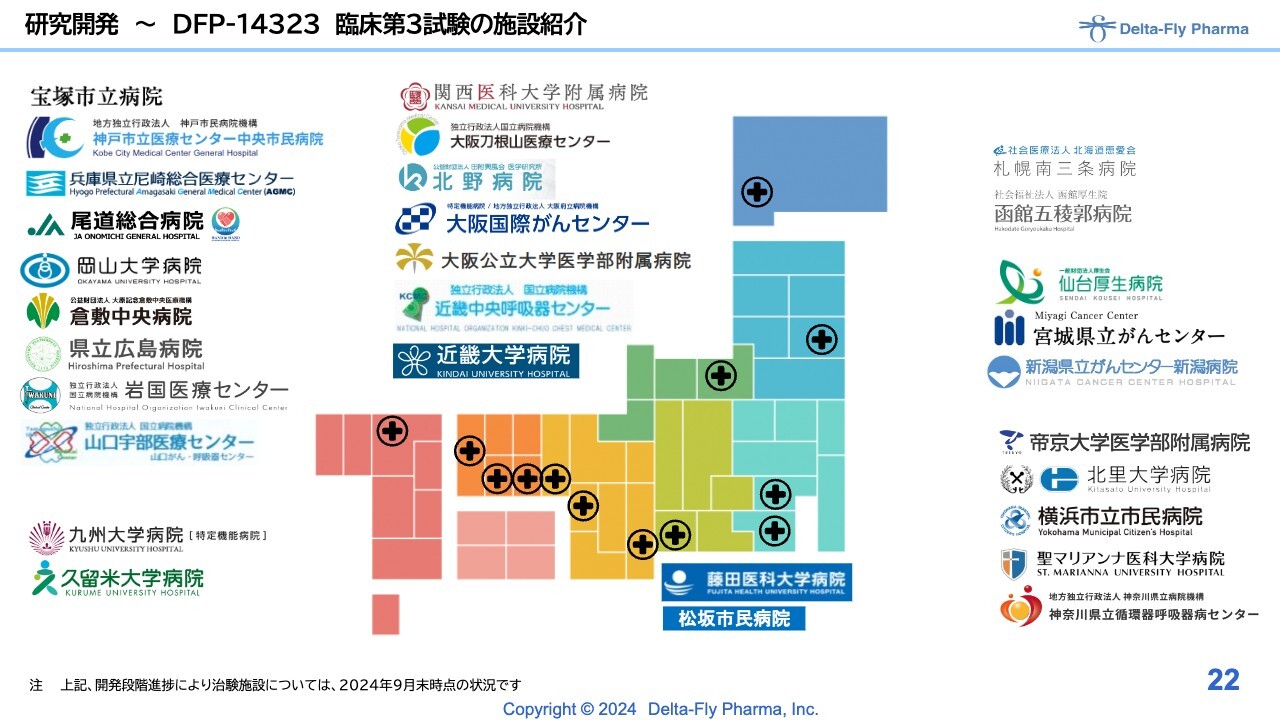
「DFP-14323」の臨床施設は、臨床第2相試験の時と比べてかなり幅広く、症例数も多いため、幅広く実施する必要性があります。そのため、北は北海道から南は九州まで、30施設の基幹病院で試験を実施しているところです。
DFP-14323の臨床第3相比較試験の開始に関するお知らせ

このような背景のもと、第3相試験の症例登録が始まったことについて、7月3日付でプレスリリースを出しました。
研究開発〜DFP-17729
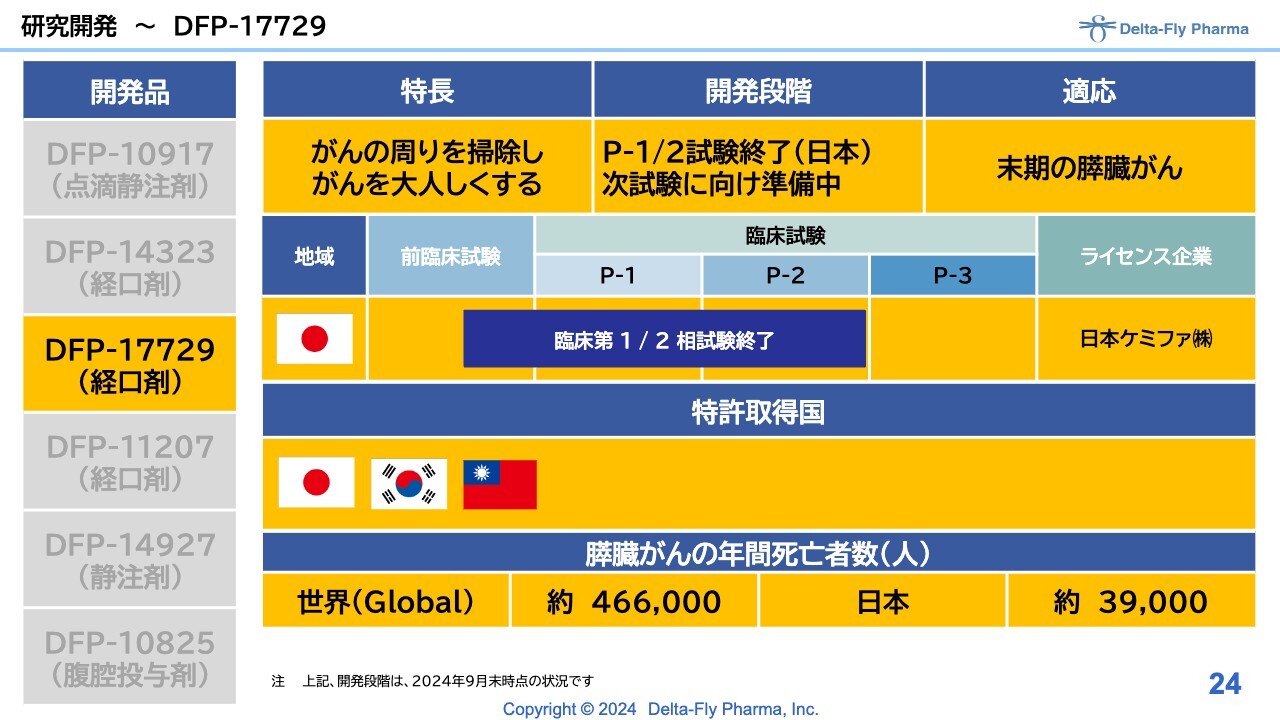
「DFP-17729」は、末期の膵臓がんの患者さまを対象にした試験です。臨床第1相試験/臨床第2相試験の解析に時間がかかったような格好ですが、現在は順調に、次試験をどうするかということを立ち上げるための作業をしているところです。
研究開発〜DFP-17729日本における膵臓がんの状況
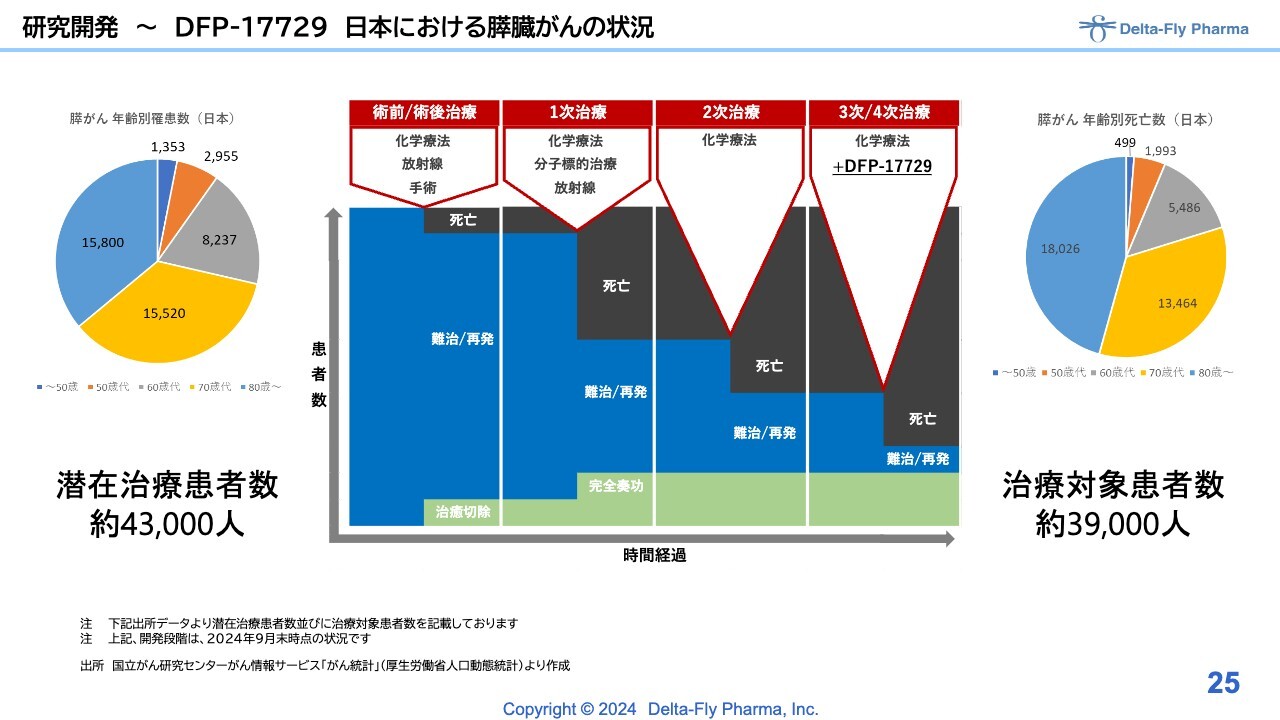
「DFP-17729」は、いわゆる化学療法の3次/4次治療を対象にした試験です。
DFP-17729の基礎試験における抗腫瘍効果薬学系雑誌「Biol Pharm Bull」に掲載
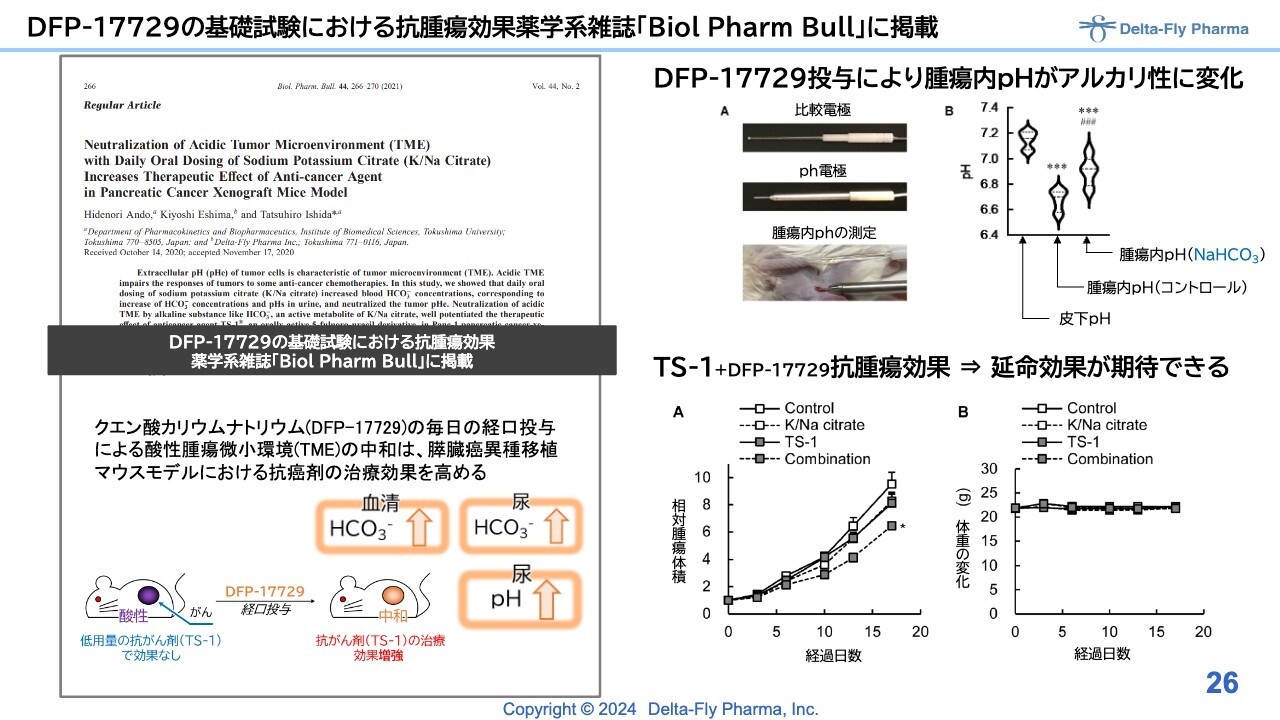
動物試験の結果は、スライドでお示ししたとおり、よく効いているため、なんとか臨床で再現できればと考えています。
DFP-14323の臨床第3相比較試験の開始に関するお知らせ

「DFP-17729」の開発状況のうち、臨床第1相試験/臨床第2相試験の層別解析の結果、「DFP-17729」の長期間治療(6週間以上)において、いわゆる被験薬群の生存期間の中央値(mOS)は9.0ヶ月、対照群の生存期間の中央値(mOS)は6.1ヶ月となりました。
こちらは臨床第2相試験、ないしは臨床第2相試験/臨床第3相試験になるかはわかりませんが、当局と相談して了解をいただく必要性があるため、このような背景のもと、次試験に向けて実施する所存です。
結果は、ドイツのミュンヘンで開かれた国際学会で発表しています。日本でも、7月26日に宇都宮市で開催された日本膵臓学会において口頭で発表しました。
研究開発〜DFP-11207

「DFP-11207」は、固形がん対象のなかでも、特に膵臓がんと胃がんの術後療法の再発防止が期待できる薬剤です。
研究開発〜DFP-11207 日本における膵臓がんの状況
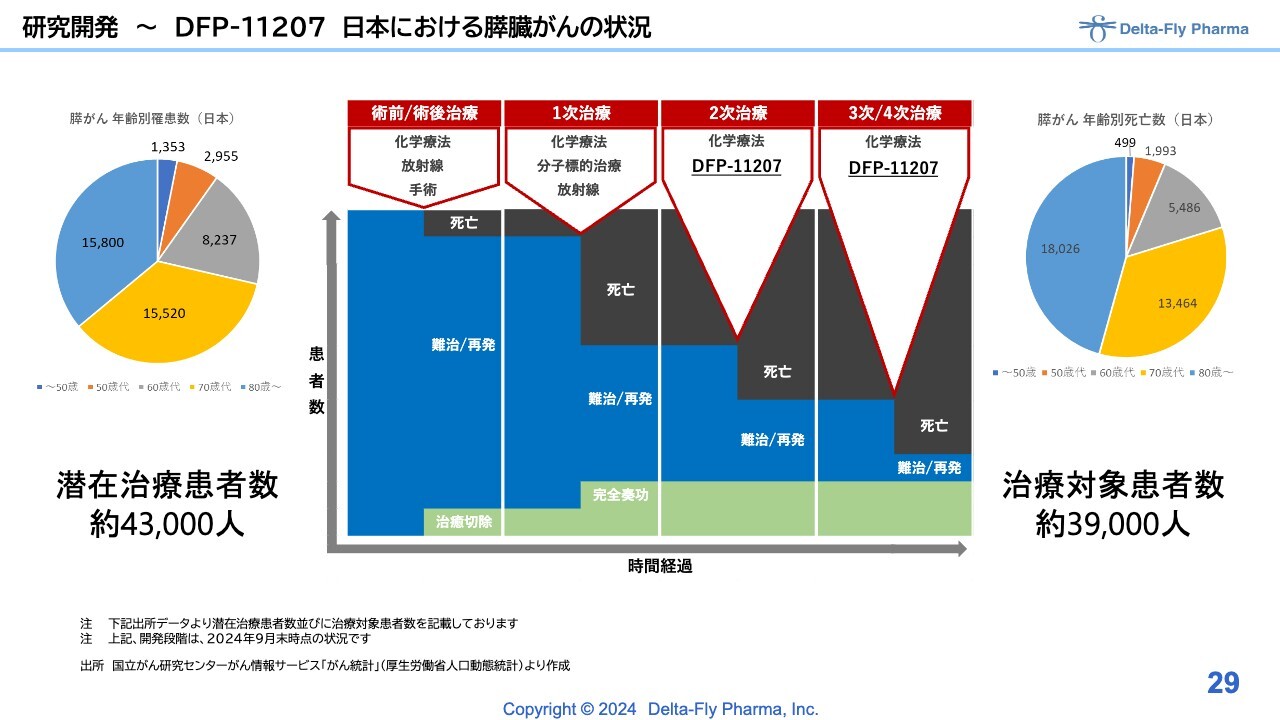
こちらは、いわゆる化学療法剤の2次治療、3次/4次治療の幅広い患者さまを対象に実施する所存です。
研究開発〜DFP-11207の臨床第1相試験での安全性確認
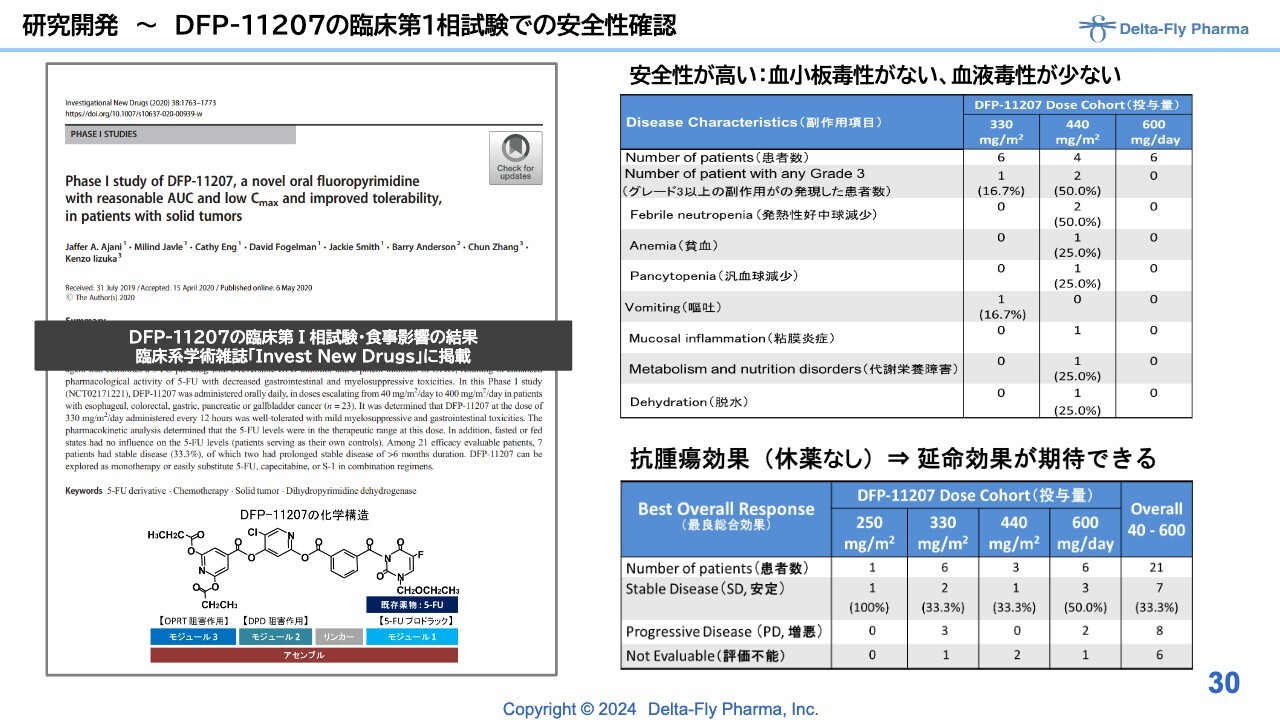
「DFP-11207」は、米国のMD Anderson Cancer Centerですでに臨床第1相試験を終えています。高い安全性と効果の片鱗も認められているため、次の実施国ないしは実施方法について当局と相談しながら進めていく所存です。
研究開発〜DFP-14927

「DFP-14927」は、「DFP-10917」のいわゆるDDSで、週1回投与型の「DFP-10917」の関連物質です。現在、固形がんを対象にした臨床第1相試験の拡大試験を行っていますが、こちらは臨床第2相試験に相当する試験です。
拡大試験の意味は、臨床第1相試験から臨床第2相試験に移る過程ではFDAと相談する必要性がありますが、拡大試験にした場合はそのような作業をせずに前に進められるため、このような手続きをとっています。
研究開発〜DFP-14927の基礎試験での薬効確認
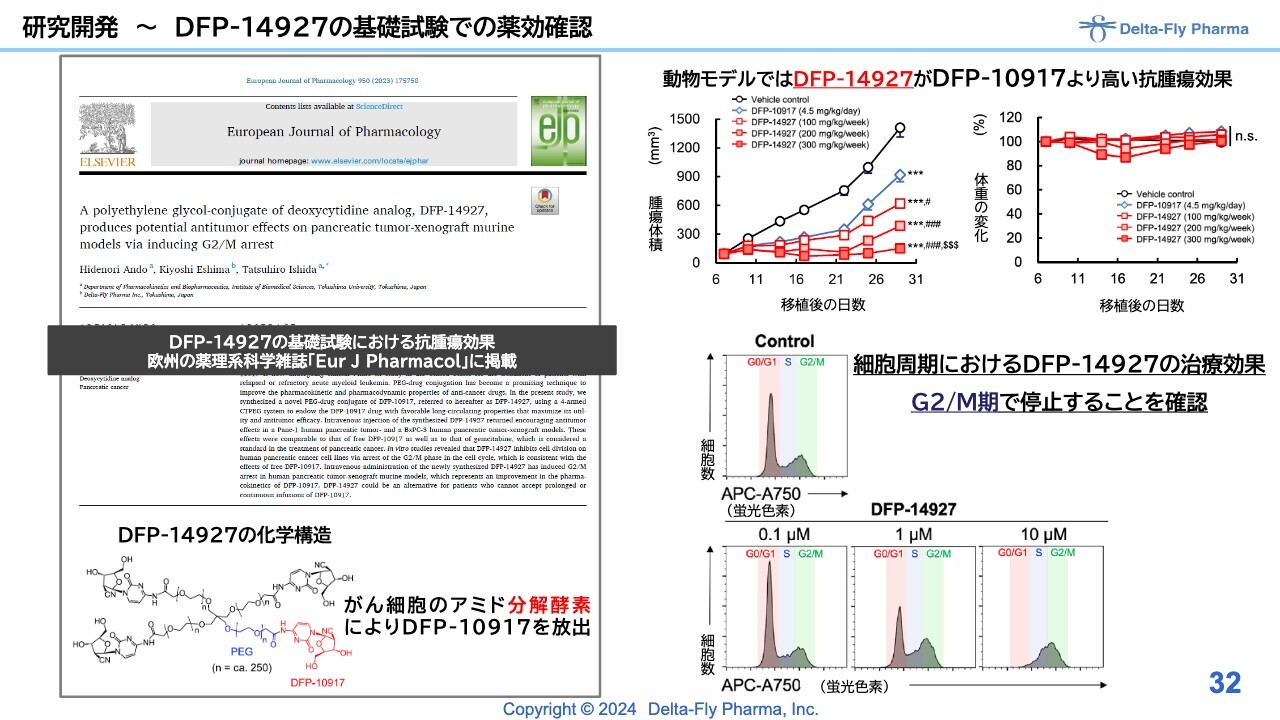
「DFP-14927」は、スライド左下に記載している構造のものです。動物試験ではよく効いている裏付けが取れており、雑誌にも論文を投稿しています。
研究開発〜DFP-10825
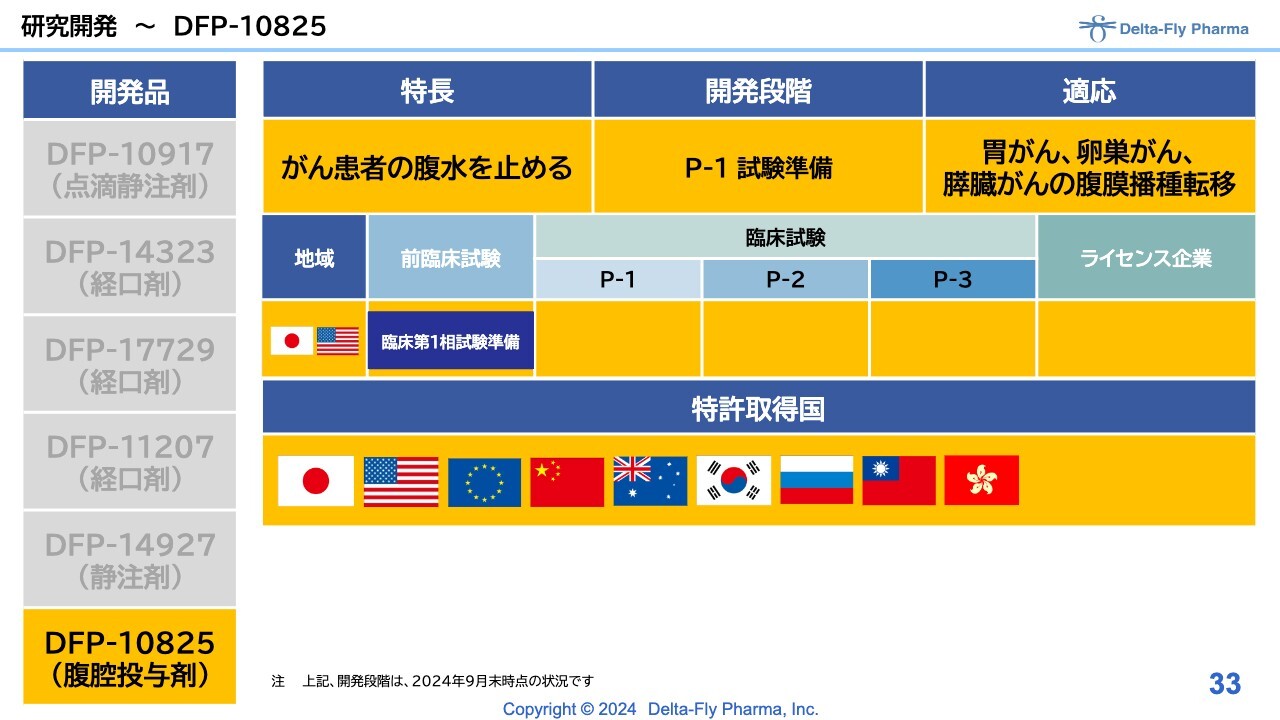
「DFP-10825」は、いわゆる核酸医薬のDDSで、腹腔内投与製剤です。当局ともこれから相談しなければなりませんが、胃がん、卵巣がん、膵臓がんの腹膜播種転移の患者さまを対象に、臨床試験を始めたいと考えています。
研究開発〜DFP-10825 (核酸医薬)の基礎試験での薬効確認
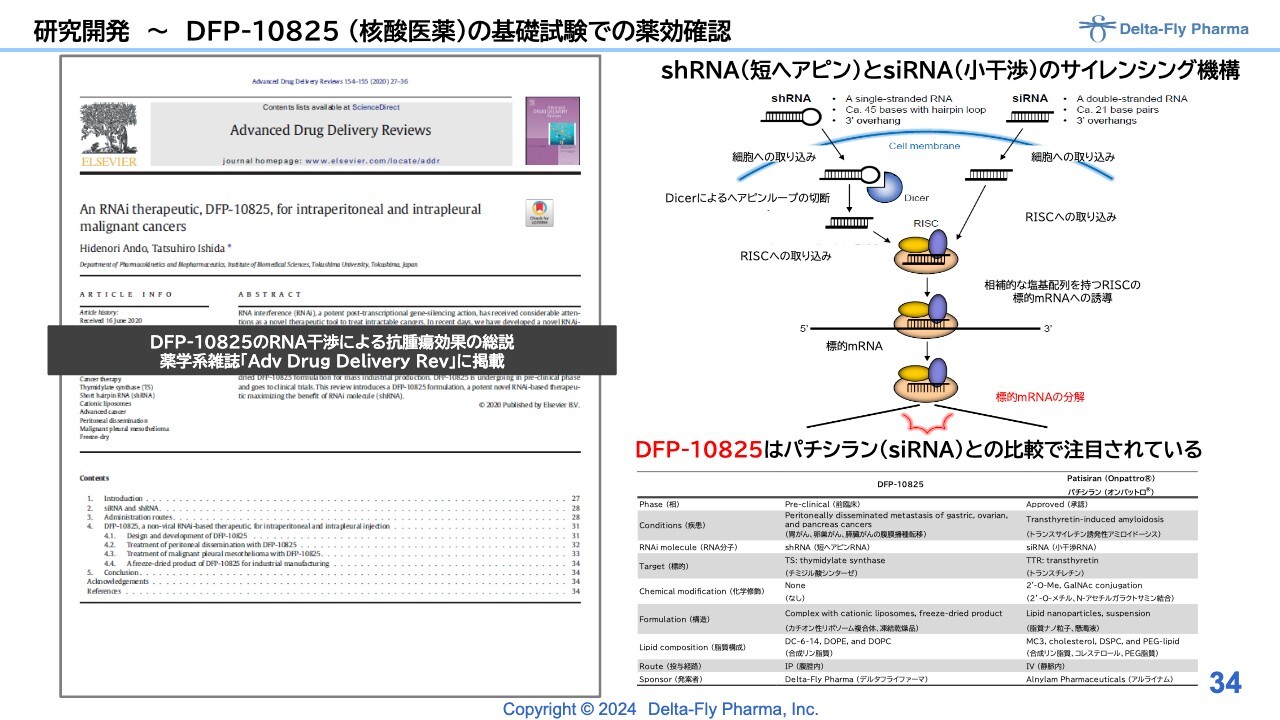
「DFP-10825」(核酸医薬)は新しい物質のため、基礎試験もかなり幅広く行っており、論文は7本ほど報告・承認されています。模式図の内容について説明を割愛します。
私からのご説明は以上です。
質疑応答:「DFP-14323」の臨床第3相試験の組入れが終わる時期について

質問者:「DFP-14323」の臨床第3相試験について、目標症例数は148例だったかと思います。こちらの組入れが終わるのは、来年の前半頃と考えてよろしいでしょうか?
江島:先ほど、スライドのタイムラインにてご説明したとおりです。
黒滝:タイムラインでお伝えすると、臨床第3相試験は今期から始まっていますが、2028年3月期を目標に148症例数を入れていく計画ですので、来年ではありません。
質問者:投与と観察期間を含めて考えると、どのへんの区切りで終わるのでしょうか?
黒滝:2027年3月期ぐらいが目標になるのではないかと思います。
質疑応答:「DFP-17729」の開発について

質問者:「DFP-17729」についてです。6月19日のプレスリリースでは、膵臓がん患者のサードライン(3次治療)以降において、生存期間の中央値(mOS)に差が認められたと記載されていますが、サードライン以降の症例数は何例だったのでしょうか?
黒滝:層別解析の3次以降の治療においては、34例です。
質問者:両群合わせて、サードライン以降で34例でしょうか?
黒滝:おっしゃるとおりです。
江島:症例数が少ないため、統計解析的にも十分な解析をするのに時間がかかります。ただし、サブ解析、いわゆる層別解析をした結果、差がつきそうだということで次試験に入りますので、当局と相談する所存です。
質問者:次の試験は、サードライン以降に限定して開発を進めていくというご意向でしょうか?
江島:おっしゃるとおりです。
質疑応答:「DFP-10917」のデータカットオフ開始時期について

質問者:「DFP-10917」に関して、データカットオフ開始予定とありつつ、かなりの時間を要するという話も説明会であったと思います。聞いてもわからないかもしれませんが、2025年の前半あたりで結果公表のイメージあるかなど、もしそのへんのタイムラインがあれば、教えてください。
江島:私どもはカットオフしたいと意思表明をしたあと、いわゆる受託会社、さらに、かなり多くの臨床施設がありますので、そのような方を対象にしてデータをまとめるのにけっこう時間がかかるということで、ご理解いただければと思います。
質問者:こちら側から訴えかけて早くなるようなものでもないとは認識していますが、イメージとしては、2025年ファーストハーフあたりには、なにかしらデータが出てきてもおかしくないと考えてよいのでしょうか?
江島:そのように進められたらと思っていますが、実際はもう少し時間がかかる可能性があります。
質疑応答:「DFP-10917」の製薬会社との提携状況について
質問者:「DFP-10917」はまもなくデータが出る段階にもなってきていますが、提携関係の状況について教えてください。前回の説明会からのアップデートや、複数というところがどのような関係になってきたのかについて、もう少しお話しいただけたらうれしいのですが、いかがでしょうか?
江島:開発・進捗とともに、ご関心をお寄せいただいている製薬会社からも当然アプローチをいただいていますが、実際に交渉して成立するまでには時間がかかります。そのような状況で具体的にどこの会社といつまでに、というのはご説明できる状況にありません。
質問者:例えば、話している会社が変わっている、あるいは引き続きずっとコンタクトされているなど、以前の説明会の時からなにか変化はありますか?
江島:ありません。開発が進んで、良いデータが出てきた場合は、当然血液がんを扱っているかなりの大手製薬会社からアプローチいただけるものと考えていますが、現状では具体的な話はできません。
質疑応答:「DFP-10917」の長期生存フォローアップ終了時期について
司会者:「『DFP-10917』の長期生存フォローアップはいつ頃終わる可能性があるのでしょうか?」というご質問です。
江島:症例数は少なくはなってきていますが、引き続きフォローアップする所存です。カットオフした時点でも、患者さまをフォローしなければいけないとご理解いただければと思います。
質疑応答:今期および来期の導出の確度について
司会者:「今期および来期の導出の可能性の確度はどのぐらいあるのでしょうか?」というご質問です。
江島:たくさんのメーカーから多大なご関心をお寄せいただけるのであれば非常にありがたいですが、開発・進捗に照らし合わせて、ご関心を持っていただける製薬メーカーが増えてくるものと考えています。
質疑応答:来期の研究開発費について
司会者:「来期も研究開発費は増えるのでしょうか?」というご質問です。
江島:先ほど黒滝からご説明したとおり、資金調達したような額は、当然必要になってくる見通しです。
黒滝:付け加えてご説明すると、「DFP-10917」単剤の部分が終了すればその分の開発費はかかりませんので、直近で一番開発費が大きいのはおそらく今期ではないかと考えています。
単剤が終われば、当然ながら導出という話が出てきます。これは先ほどのご質問にも直結しますが、同じタイミングでみなさまに関心をいただいているということですので、もし導出、ライセンスの提携ができれば、そちらのキャッシュインもあります。それが入った段階でまた次の新しい開発も検討していかなければならないと思っていますが、現状では、単剤が終われば来期は今年よりはかからないと考えています。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4598
|
217.0
(02/24)
|
-2.0
(-0.91%)
|
関連銘柄の最新ニュース
-
デルタフライ(4598) 2026年3月期第3四半期_決算説明資料 02/13 15:35
-
デルタフライ(4598) 2026年3月期第3四半期決算短信〔日本... 02/13 15:35
-
デルタフライ、4-12月期(3Q累計)最終が赤字縮小で着地・10-... 02/13 15:35
-
東証グロース(大引け)=値下がり優勢、ククレブ、イメージ情報がS高 02/02 15:33
-
デルタフライ(4598) 第9回新株予約権の行使価額及び下限行使価... 02/02 15:30
新着ニュース
新着ニュース一覧-
今日 05:00
-
今日 04:45
-
今日 04:32

