【QAあり】クリングルファーマ、脊髄損傷急性期の第Ⅲ相試験終了、PMDAとの協議を実施 製造販売に備え社内体制整備へ
アジェンダ

安達喜一氏(以下、安達):みなさま、こんにちは。クリングルファーマ株式会社代表取締役社長の安達喜一です。本日は、当社の2024年9月期第2四半期決算説明会にお集まりいただき、誠にありがとうございます。
本日のアジェンダです。はじめに2024年9月期上半期のトピックス、続いて開発パイプラインの進捗状況として、第1パイプラインの脊髄損傷急性期、声帯瘢痕、筋萎縮性側索硬化症(ALS)についてご説明します。
そして成長戦略、最後に2024年9月期第2四半期の決算概況をご説明し、質疑応答を行います。
会社概要

当社は「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者に対して画期的な治療手段を提供し、社会に貢献すること」を企業理念とし、2001年に大学発ベンチャーとして設立されました。現在、私たちは日本で発見された、再生創薬シーズであるHGFの組換えタンパク質の開発を行っています。
HGFの国際一般名称は「Oremepermin Alfa(オレメペルミン アルファ)」と決定しています。スライドにHGFの二次構造の絵がありますが、一言で言うと、非常に複雑な構造を持つ生体内のタンパク質です。もともとは肝臓の再生にかかわるタンパク質として見つかりましたが、その後の研究で、体中の組織・臓器の再生修復を担う、非常に重要なタンパク質であることがわかっています。
この複雑なHGFタンパク質を、医薬品のグレードで大量製造する体制を私たちはすでに整えており、現在、臨床開発を進めているところです。
2024年9月期上半期のトピックス(後発事象を含む)

2024年9月期上半期のトピックスです。当社は、レイトステージの開発パイプラインを複数持つことを特徴としますが、第1パイプラインの脊髄損傷急性期では、第Ⅲ相臨床試験の最終症例の最終観察日が2023年10月に終了し、データ固定、解析を終えて、第Ⅲ相試験の速報を2024年の2月に発表しました。現在、PMDAとの協議を開始しており、こちらについては後ほどお話しします。
第2パイプラインの声帯瘢痕については、すでに第Ⅲ相試験へ組入れを進めており、昨日、第Ⅲ相試験の実施医療機関を新たに1施設追加するとリリースしたところです。これをもって、患者の組入れの加速を図っていきます。
また上半期は、アカデミアとの共同研究にも非常に大きな進捗がありました。これは既存パイプラインの推進と、新規パイプラインの創製につながるものです。
1つ目に、ALSを対象とする第Ⅱ相臨床試験の追加解析について、東北大学と共同研究を開始しました。2つ目に、HGFの突発性大腿骨頭壊死症への応用研究に関して、岐阜大学との共同研究を開始しました。これらについては、後ほどご説明します。
開発パイプラインの概要
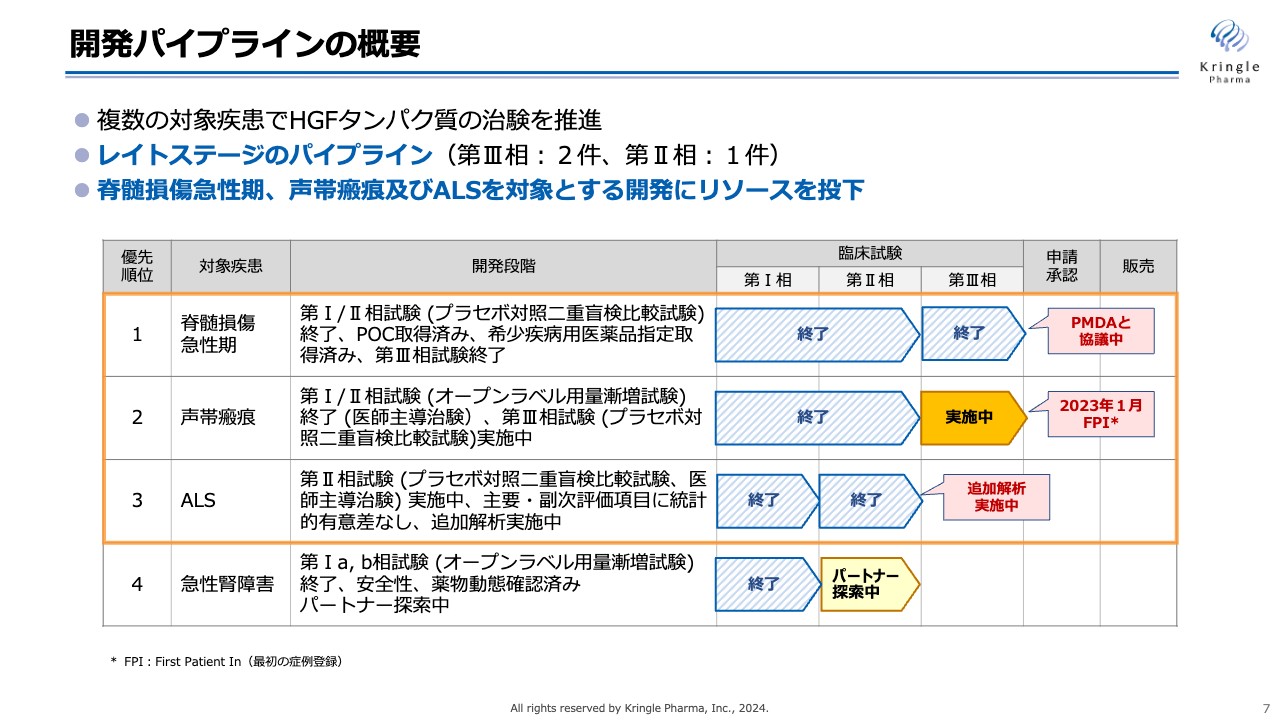
開発パイプラインの進捗状況です。スライドの図は、当社が持っている4つの臨床段階のパイプラインの状況を表しています。第1パイプラインの脊髄損傷急性期は国内で第Ⅰ/Ⅱ相試験が終了し、第Ⅲ相試験が先般終わり、現在PMDAと協議を進めています。
第2パイプラインの声帯瘢痕は、国内で第Ⅰ/Ⅱ相試験を終了し、現在は第Ⅲ相試験を実施中です。第3パイプラインのALSは第Ⅱ相試験まで終了し、現在、追加解析を実施中です。第4パイプラインの急性腎障害は米国で第Ⅰ相試験が終了し、現在はパートナーの探索中です。
開発パイプライン-脊髄損傷急性期-

各パイプラインについて、ご説明します。まずは脊髄損傷急性期です。日本では現在、年間約6,000人の方が転倒、あるいは事故で脊髄損傷になっています。損傷部位が脳に近いほど、広範な麻痺が残り、患者だけでなくご家族や介護者の負担も非常に大きい、アンメットニーズの高い疾患です。現在、薬剤や手術などによる根本的な治療法はありません。
脊髄損傷急性期にHGFに期待する治療効果
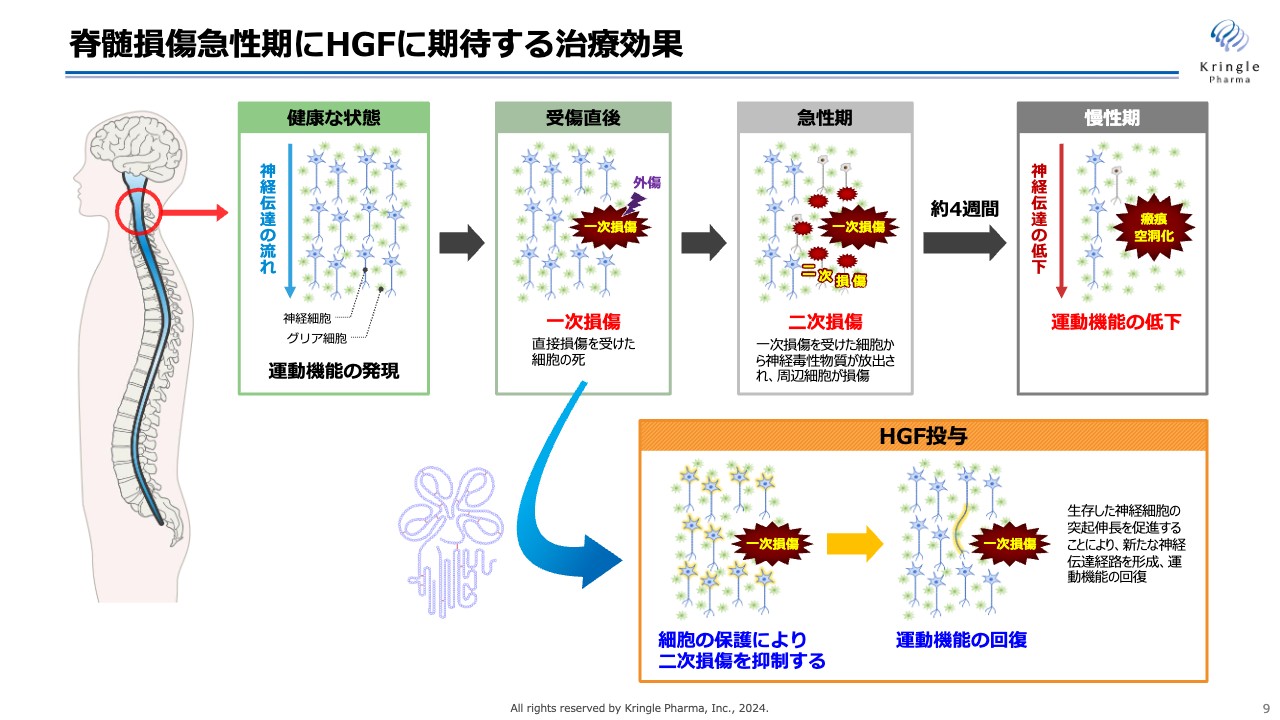
脊髄損傷において、最初の損傷を一次損傷と呼びますが、私たちがHGFに期待しているのは、これが急性期に二次損傷として周りの組織・細胞へ広がっていくのを抑えることです。
二次損傷がどんどん広がると、慢性期にはその部分が瘢痕・空洞化し、神経伝達が上から下に伝わらなくなり、運動機能が低下します。神経系の細胞を保護して細胞死を抑える働き、炎症を抑制する働き、血管新生といった、HGFの持つマルチな働きをもって、急性期に二次損傷が広がっていくのを抑えます。
可能な限り損傷範囲を抑えることで、患者の予後、運動機能の回復を期待するというものです。
脊髄損傷急性期 第Ⅰ/Ⅱ相試験の結果
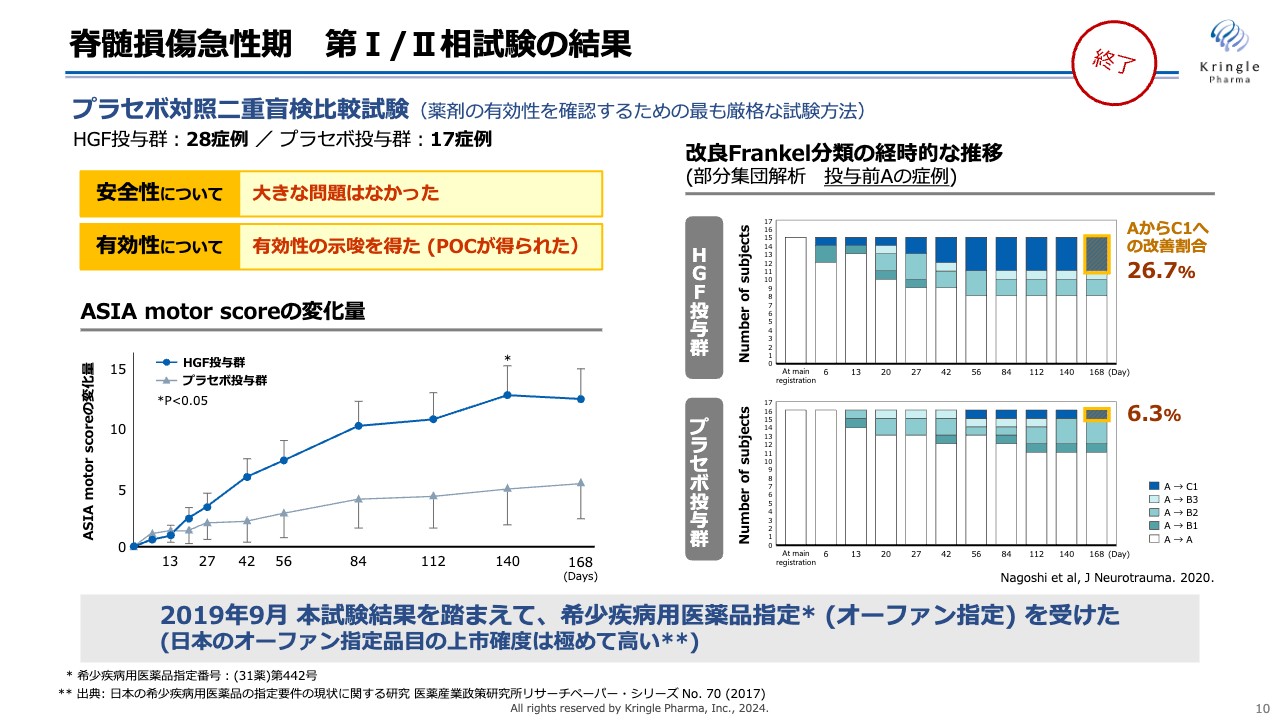
私たちはすでに、薬剤の有効性を確認するための最も厳格な試験方法である、プラセボ対照二重盲検比較試験として、第Ⅰ/Ⅱ相試験を終了しています。
スライドでは、HGF投与群28例、プラセボ投与群17例を比較しています。左下のグラフは、6ヶ月間の「ASIA motor score」の変化量を表しています。プラセボ投与群と比較して、濃い青い線で示したHGF投与群は、常に高いスコアを獲得しています。140日目の時点では、統計的な有意差も得られました。
右側のグラフは、重症度分類Aの部分集団解析です。重症度Aとは、運動機能・感覚機能がまったくない、最も重度な脊髄損傷のことです。最も重度な脊髄損傷で、6ヶ月の経過観察の間に、重症度がAからB、あるいはAからCに改善した方を着色して示しました。
濃い青色の部分にご注目ください。HGFを投与した群では、最終的に26.7パーセントの方が、AからC1に改善しています。プラセボ投与群では6.3パーセントでした。
このような大きな改善効果を認め、2019年の9月には、国から希少疾病用医薬品指定(オーファン指定)を受けています。日本では、オーファン指定を受ける基準が非常に厳しく設定されており、開発の確度が問われます。言い換えると、日本でオーファン指定を取れば上市の確度が極めて高いことが、過去のデータでも報告されています。
脊髄損傷急性期 第Ⅲ相試験(医薬品開発の最終段階)
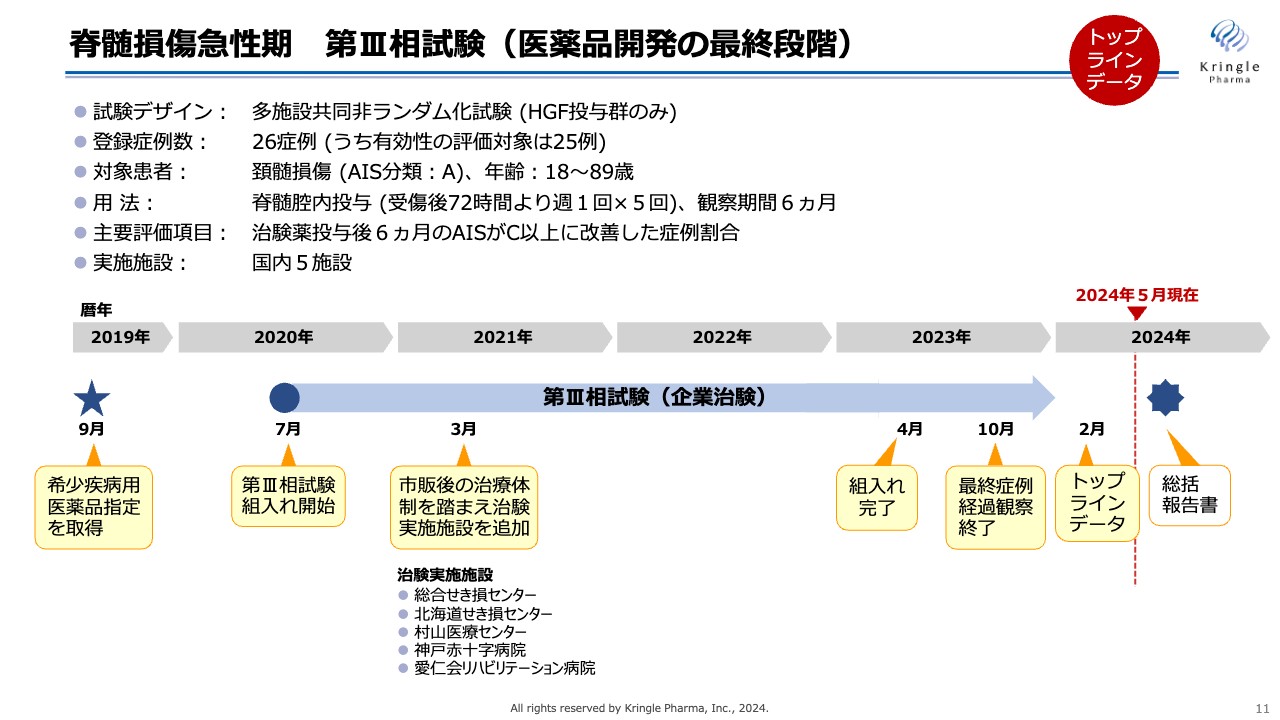
オーファン指定を受けた後に、第Ⅲ相試験を開始しています。この試験は多施設共同非ランダム化試験で、HGF投与群のみからなる試験です。26症例を登録し、うち有効性の評価対象は25例となりました。
頚髄損傷、つまり首の損傷については、最も重度な重症度Aの方を選び、用量・用法は前相と同じです。主要評価項目は、治験薬投与後6ヶ月時点で重症度がAからC以上に、2段階以上改善した症例割合と設定しています。
患者の組入れ開始は2020年の7月と、コロナ禍の真っ只中での試験となり、多大な影響を受けました。まず、脊髄損傷の患者がコロナ禍で減ったため、組入れに非常に苦労しました。しかし国内の5施設で協力を得て、2023年の4月に組入れを完了し、今年の2月にトップラインデータとして結果を公表しています。
現在は事後解析を鋭意進めており、そちらも含めた総括報告書を取りまとめているところです。
脊髄損傷急性期 第Ⅲ相試験 -重症度の改善-
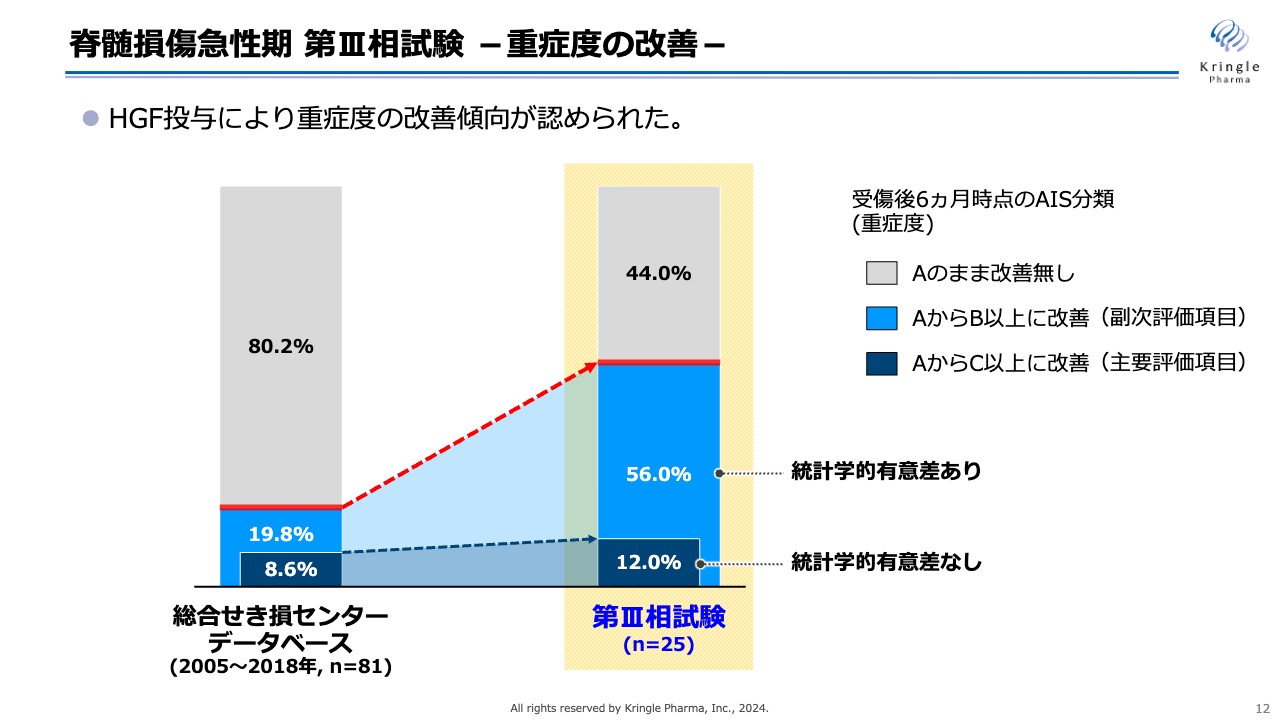
トップラインデータとして公表した第Ⅲ相試験の結果について、要点をご説明します。スライドのグラフは、重症度の改善を示したものです。中央の黄色い四角が今回の第Ⅲ相試験です。左側は今回の試験の比較対象となる総合せき損センターのデータベース、つまり患者のヒストリカルなデータです。
こちらのデータベースは、2005年から2018年まで、約1,000名の脊髄損傷の患者データが含まれています。このうち、頚髄損傷で受傷後3日目の時点で重症度がAの方、かつ6ヶ月時点のデータがきちんとそろっている方を選ぶと、症例数は81例となります。
灰色の部分は重症度Aで、6ヶ月後も重症度Aのままの方、薄い青色はAからB以上に改善を認めた方、濃い青色はAからC以上に、2段階以上改善した方となります。
今回の試験の主要評価項目である2段階以上の改善については、総合せき損センターのデータベース8.6パーセントに対し、今回の試験は12パーセントと数字は大きくなりましたが、統計的な有意差は認められませんでした。
一方でAからB以上への改善は、総合せき損センターのデータベース19.8パーセントのところ、56.0パーセントと非常に大きく増加し、統計学的な有意差が認められています。
脊髄損傷急性期 第Ⅲ相試験 -重症度の改善、海外データベースとの比較-
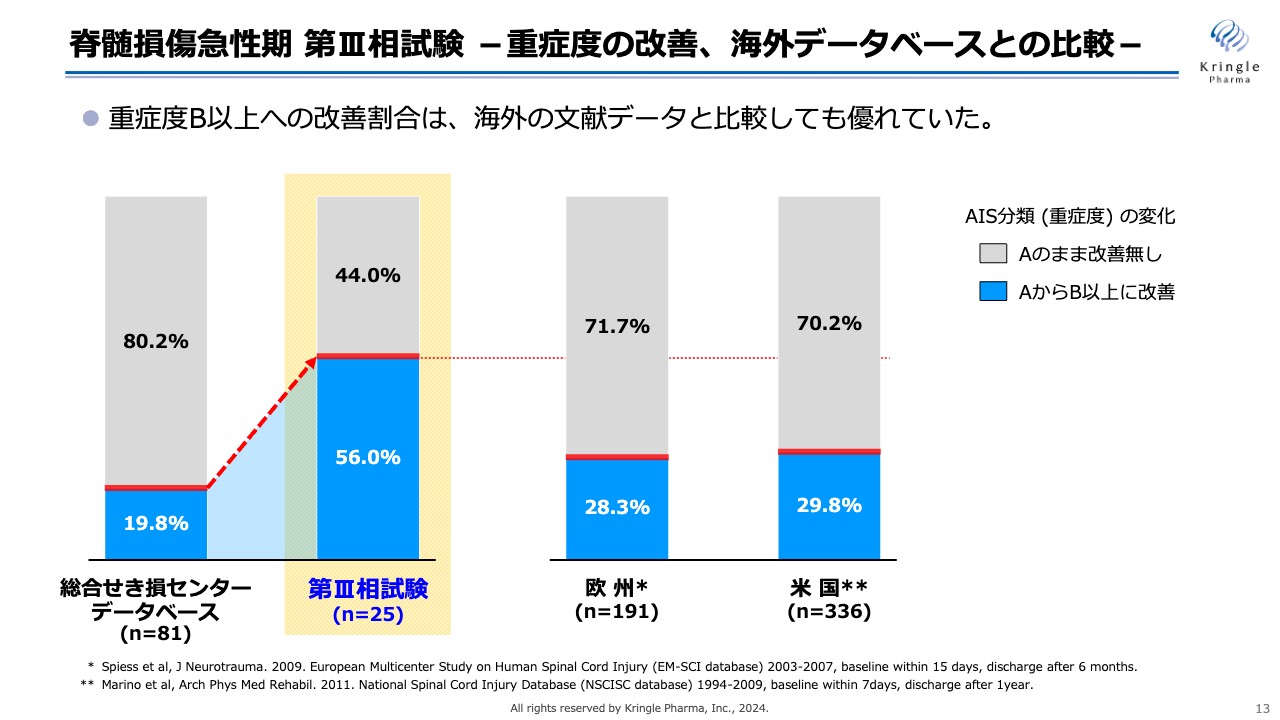
今回の第Ⅲ相試験のデータを、海外のデータベースと比較してグラフにしました。文献として、欧州と米国のデータベースが報告されています。その報告によると、頚髄損傷では重症度Aの方の約7割がAのままで推移し、残りの3割の方がB以上に改善するということです。
今回の私たちの第Ⅲ相試験では、半分以上の方がAからB以上に改善しており、国内のデータベースだけでなく、海外のデータベースと比較しても非常に優れたデータであることがわかります。
急性期完全麻痺患者に対するHGFの効果
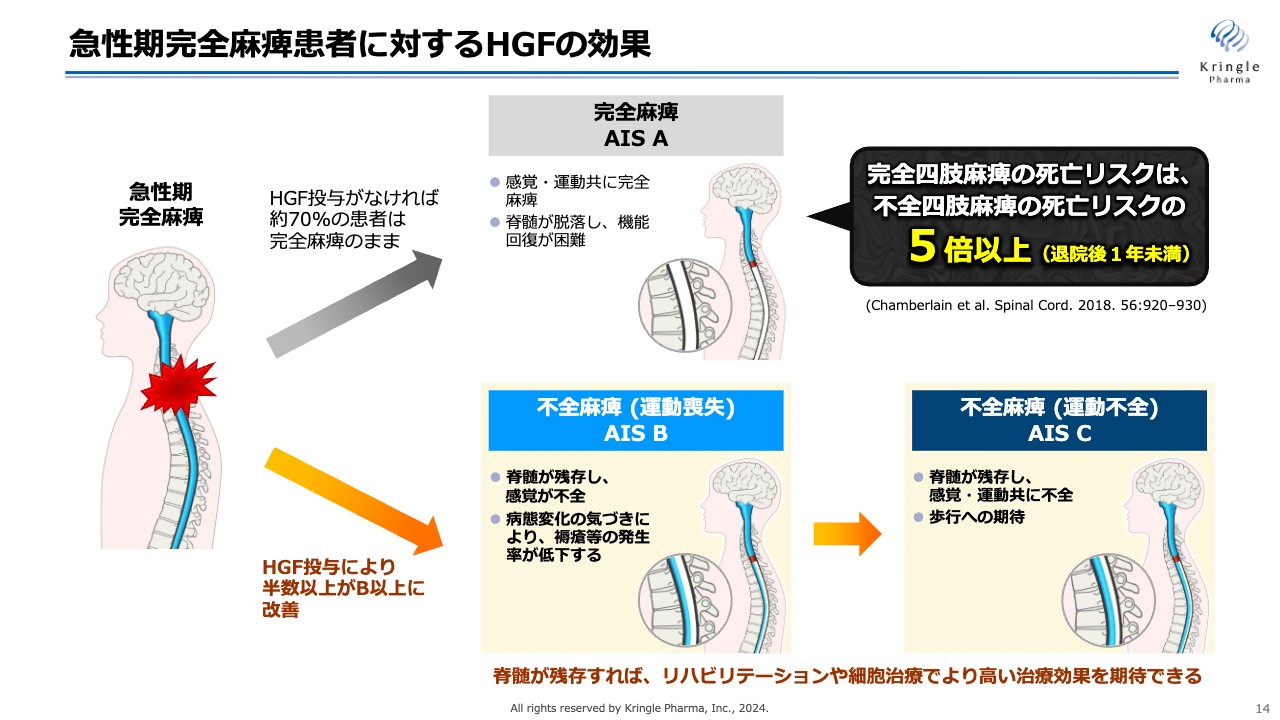
スライドは、頚髄損傷の急性期完全麻痺の方に対するHGFの重要性を表したものです。完全麻痺のAIS Aの方は、何もしなければ約7割がAIS Aのままで推移します。このまま慢性期に入ってしまうと脊髄が脱落してしまうため、この後の機能回復は非常に厳しくなります。
一方でHGFを投与すると、半数以上の方がオレンジ色の矢印のラインを辿り、不全麻痺のAIS Bに移行します。AIS Bは神経が残存し、感覚が戻ってくるため、患者自身が病態の変化に気づくことができます。これにより、褥瘡等の発生が低下することが文献としても報告されています。
さらにAIS Cまで改善すると、運動機能が戻ってくるまでに回復し、歩行への期待、あるいは上肢の動きへの期待が大きくなってきます。
いずれにしても、神経が残っている状態、不全麻痺に移行させるのが、脊髄損傷の急性期の治療で最も重要なことです。それが、HGFによって達成できるということです。第Ⅲ相試験と前相で同じ結果が得られたことが、今回の臨床試験の意義だと考えています。
不全麻痺の場合は脊髄が残存しているため、その後のリハビリ、あるいは細胞治療を施すことにより、さらに高い治療効果が期待できます。なお、完全麻痺のAIS A、いわゆる完全四肢麻痺の方の退院後の死亡リスクは、不全麻痺の方の5倍以上であることが、論文としても発表されています。
繰り返しになりますが、脊髄損傷の急性期に完全麻痺のままで移行させず、不全麻痺であるAIS B以上に改善させるのが極めて重要なことです。
脊髄損傷急性期 第Ⅲ相試験 -レスポンダーの割合、前相との比較-
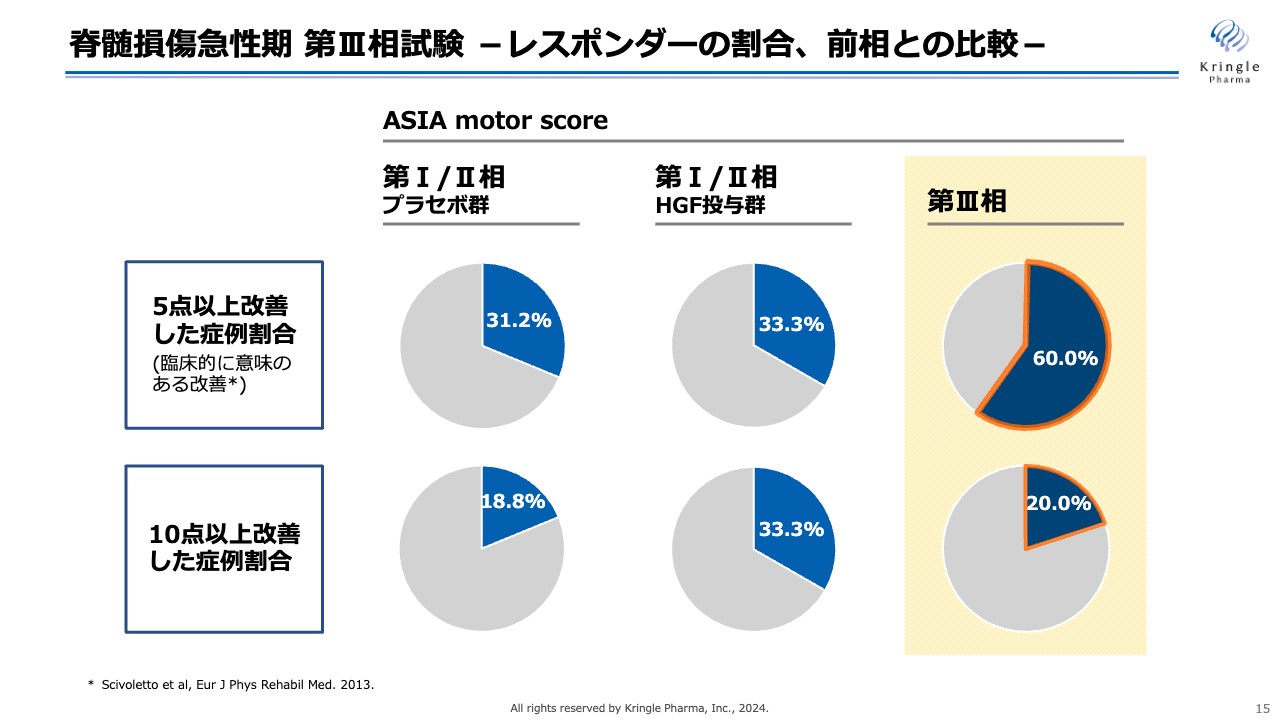
スライドは、「ASIA motor score」の比較を表したものです。文献上、臨床的に意味のある改善と言われている、5点以上改善した症例割合に加え、10点以上改善した症例割合を円グラフで示しています。
今回の第Ⅲ相試験では、5点以上改善した方が60パーセントでした。一方で、10点以上改善した方は20パーセントと、前相のプラセボとあまり差がありませんでした。しかしながら、前相の実薬投与群では、10点以上改善する方で大きな差が見られました。
このことから、前相と今回の第Ⅲ相試験で、患者の背景が異なるのではないかということが見えてきました。
脊髄損傷急性期 第Ⅲ相試験 -患者背景に関する考察-

私たちは患者背景を、年齢、受傷原因、その他さまざまな要因で分析しました。その結果、前相と今回の試験とでは、やはり患者背景が異なることが見えてきました。
前相の第Ⅰ/Ⅱ相試験では、高齢者の転倒・転落による、中心性頚髄損傷と呼ばれる症例が多く組入れられました。中心性頸髄損傷は下肢が回復しやすいため、改良Frankel分類でCまで改善する症例、「ASIA motor score」が10点以上改善する症例が非常に多かったということです。
一方で、今回の第Ⅲ相試験はコロナ禍中の試験ということで、日本中に行動制限がかかっていましたが、おそらく高齢の方ほど行動制限されたため、高齢者の脊髄損傷が減り、相対的に若い方・壮年層が増えました。
若い方の脊髄損傷は交通事故やスポーツなど、いわゆる高エネルギー外傷を伴う、重度の中でもより重度な症例です。このような方が多かった結果、AIS Bまで改善した症例、「ASIA motor score」が5点以上改善した症例が非常に多かったものの、AIS Cあるいは「ASIA motor score」が10点以上改善するまでには至らなかったと考察しています。
しかしながら、今回と前相を合わせた2本の試験で、患者の改善傾向が明確に確認できたため、私たちはこれを非常にポジティブに捉えています。
脊髄損傷急性期の臨床試験は海外等でも行われていますが、ことごとく失敗してきた歴史があります。そのような試験では、最初の試験で効果が見られたものの、2本目の試験でうまくいかず開発中止となる事例が多くありました。
私たちは2本の試験で、しかも患者背景が異なる中で同じように改善傾向を認めている点で、非常にポジティブな結果であると捉えており、現場の先生方も非常に期待しています。
脊髄損傷急性期 承認申請に向けた準備状況

承認申請に向けた、一連の準備状況です。第Ⅲ相試験については現在、事後解析をさまざまな角度で進めています。これらは総括報告書の取りまとめに入っています。
事後解析の途中ですので、本日は詳細に述べられませんが、非常に興味深いデータが出てきました。こちらについては後々、学会あるいは論文としてきちんと発表します。
並行して、PMDAとの協議を開始しています。協議は大きく3段階に分かれています。まずは大まかな課題を整理する事前面談を行い、その後、書類の内容を細かく審査する申請前相談に移ります。ここでOKになると、製造販売承認申請に至るという流れですが、現在、PMDAとの事前面談を実施中であり、PMDAの指摘事項への対応を進めている状況です。
製造販売承認申請には、臨床試験だけでなく、非臨床試験やタンパク質の製造に関する膨大なデータも申請書類としてまとめる必要があり、製造販売承認申請パッケージの作成にも着手しています。
さらに、私たち自身が製造販売承認申請を行いますので、承認申請の前に製造販売業許可を取得しなければなりません。その取得には、三役という役割の人材を社内に配置する必要があります。このような、新しい社内体制の整備も進めているところです。
開発パイプライン -声帯瘢痕-

第2パイプラインの声帯瘢痕です。声帯瘢痕というのは線維化疾患の一種です。声帯が何らかの原因で線維化して硬くなり、きちんとバイブレーションしなくなってしまいます。最初は声が出にくくなって、ひどくなると声が出なくなる疾患です。
日本では、約3,000人から1万2,000人の方が声帯瘢痕と診断されており、現在有効な治療法はまったくありません。命を脅かすことはありませんが、誰もが当たり前のように使っている声が出なくなるため、患者のQOLを著しく損なう深刻な疾患です。
声帯瘢痕に対するHGFの作用機序
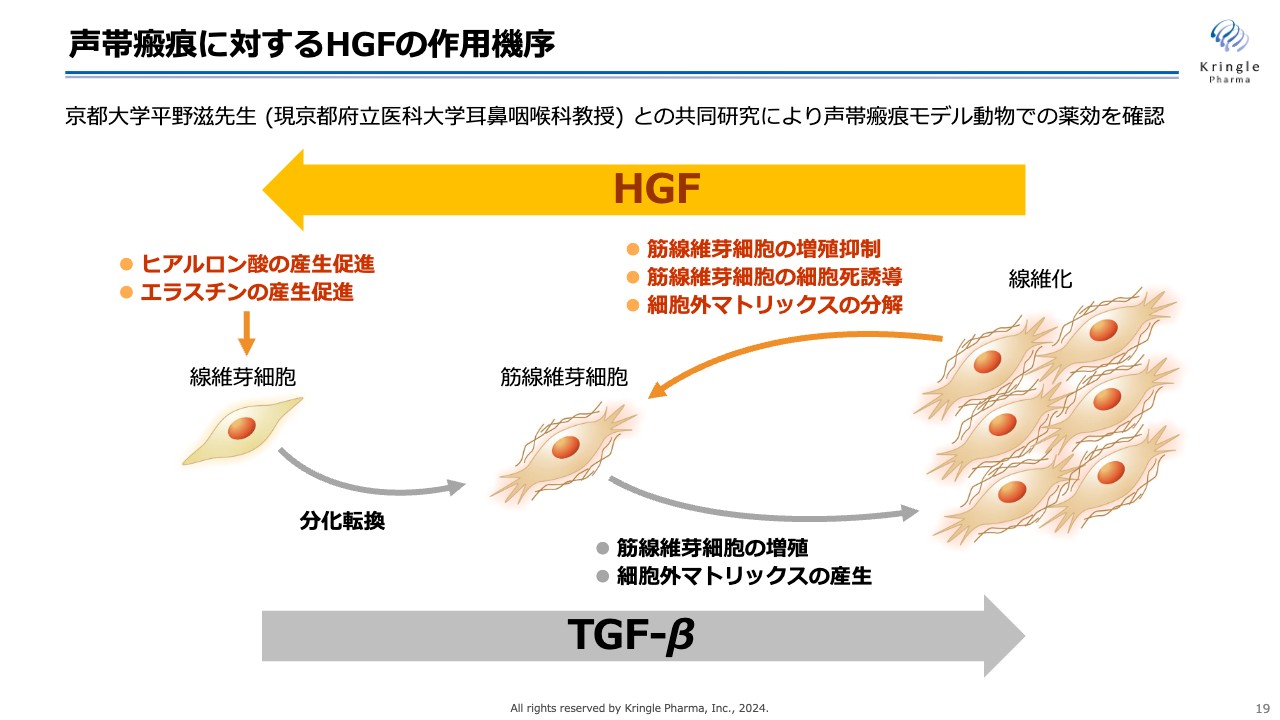
HGFにはマルチな作用があります。中でも線維化を抑える、線維化を逆向きに進める働きがあることがわかっています。
スライドでは、左から右への線維化の進行をイラストにしていますが、HGFは、その線維化を右から左へ移す働きがあります。筋繊維芽細胞の増殖を抑制したり、細胞死を誘導したり、コラーゲンのような細胞外マトリックスの分解を促進したりします。
また、ヒアルロン酸やエラスチンなど、柔らかい成分の産生を促進するため、線維化疾患に対して効果があると考えられています。
声帯瘢痕 第I/II相試験の結果
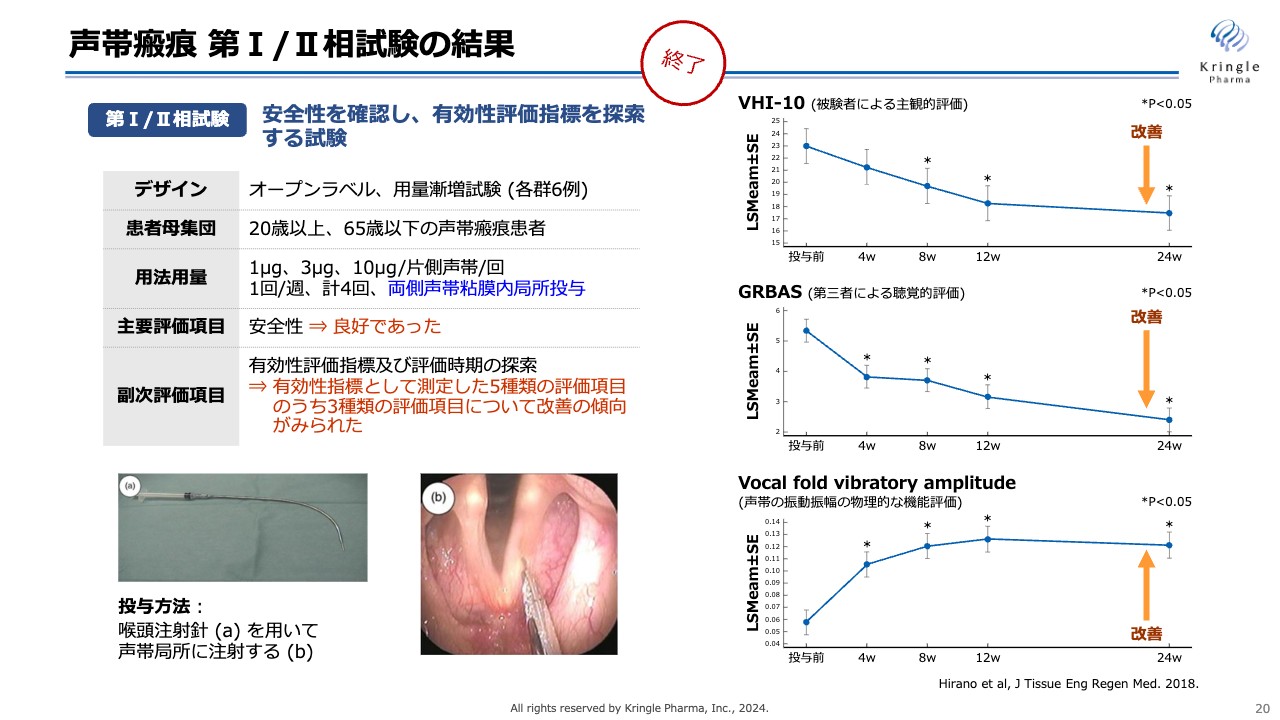
すでに私たちは、第Ⅰ/Ⅱ相試験、オープンラベルの用量漸増試験を終了しており、患者での効果の改善傾向を確認しています。
声帯瘢痕に対しては、スライドの写真のように咽頭注射針を使って、HGFを声帯の局所に直接注射します。これにより、スライド右側にある3種類の評価指標で改善傾向が認められており、こちらも非常にポジティブな結果でした。
声帯瘢痕 第III相試験(医薬品開発の最終段階)
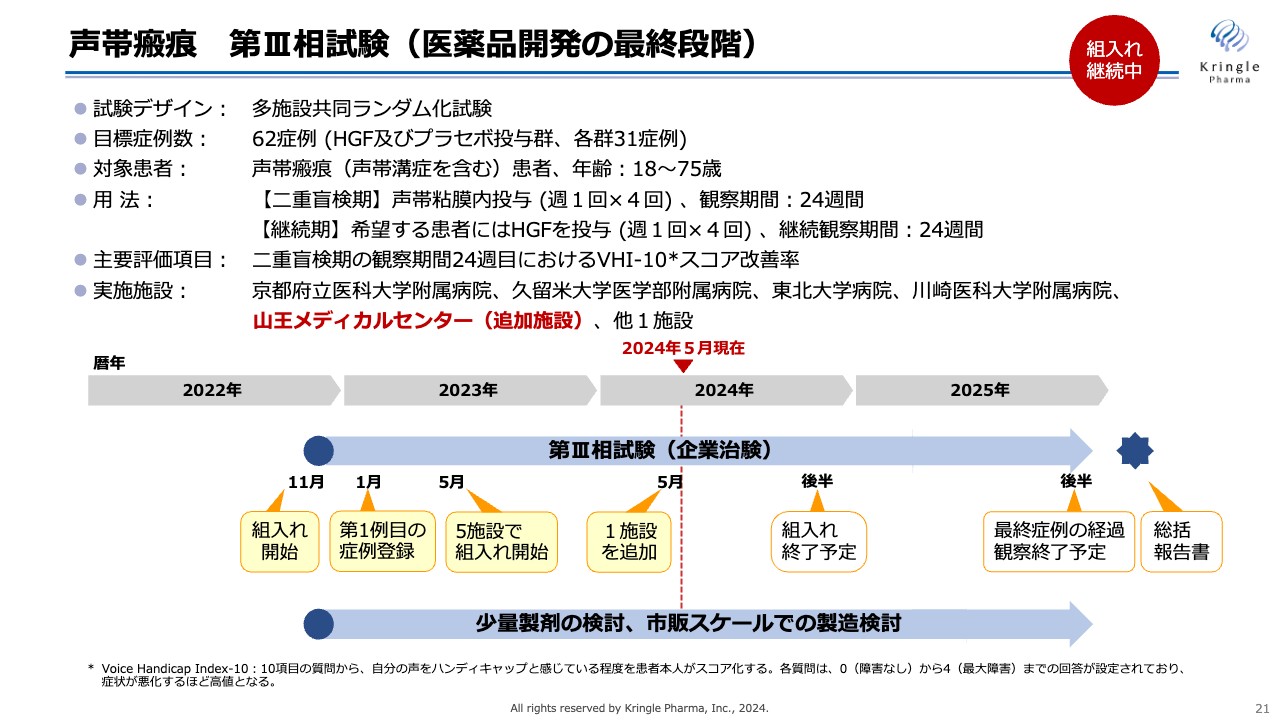
現在、第Ⅲ相試験として多施設共同ランダム化試験を進めています。目標症例数は62例であり、HGF群およびプラセボ投与群、それぞれ31例です。
声帯瘢痕患者の声帯粘膜に週1回の投与を4回繰り返し、6ヶ月経過を観察するのが二重盲検期、その後、希望する患者にはHGFを投与し、さらに6ヶ月観察するのが継続期です。主要評価項目は、二重盲検期である6ヶ月時点での、「VHI-10」のスコアの改善率としています。
この試験は、2023年1月に第1例目の症例を京都府立医科大学附属病院で登録し、その後、全国5施設で組入れを進めてきました。今般、東京の山王メディカルセンターを治験施設として追加し、さらに症例組入れを加速していきます。
現時点では、2024年末までに組入れを行い、2025年末までに最終症例の経過観察を終了したいと考えています。臨床試験と並行して、声帯瘢痕用の少量製剤の検討、市販スケールでの製造検討も進めており、こちらも順調に進んでいます。
開発パイプライン -ALS-

第3パイプラインのALSです。ALSは神経難病の象徴的な疾患で、運動神経が細胞死を起こすことによって体が動かなくなり、最終的には呼吸ができなくなって死に至ります。日本では、約1万人の方がALSと診断されています。
既存薬はありますが、効果は限定的です。引き続き、効果のある薬が非常に望まれている、アンメットニーズの高い疾患です。
ALS 第II相試験(医師主導治験)

当社は東北大学と第Ⅱ相試験(医師主導治験)を実施し、すでに終了しています。こちらは、プラセボ対照二重盲検比較試験として実施しました。データの速報として、主要評価項目、副次項目で統計的な有意差が見られなかったと報告しています。
しかしながら、HGF投与群で進行の遅い症例も認められましたので、追加解析として、東北大学と共同研究をスタートしています。共同研究では、バイオマーカーの測定を行います。保管してある患者の検体を使って、神経変性や神経炎症のバイオマーカーを測定し、HGF投与による効果との相関を検証することが目的です。
ALSについては、現在バイオマーカーが非常に着目されています。特に神経変性のバイオマーカーであるニューロフィラメント軽鎖(neuro lament light chain)の測定においては、米国FDAがこのデータをもとに承認を出したという、他社のパイプラインの前例があります。ですので、ALSの臨床試験ではバイオマーカーを測ることがスタンダードになりつつあります。
今回のバイオマーカーの測定は複数の項目を測定しますが、もちろん、ニューロフィラメント軽鎖も含めています。
患者数と市場規模
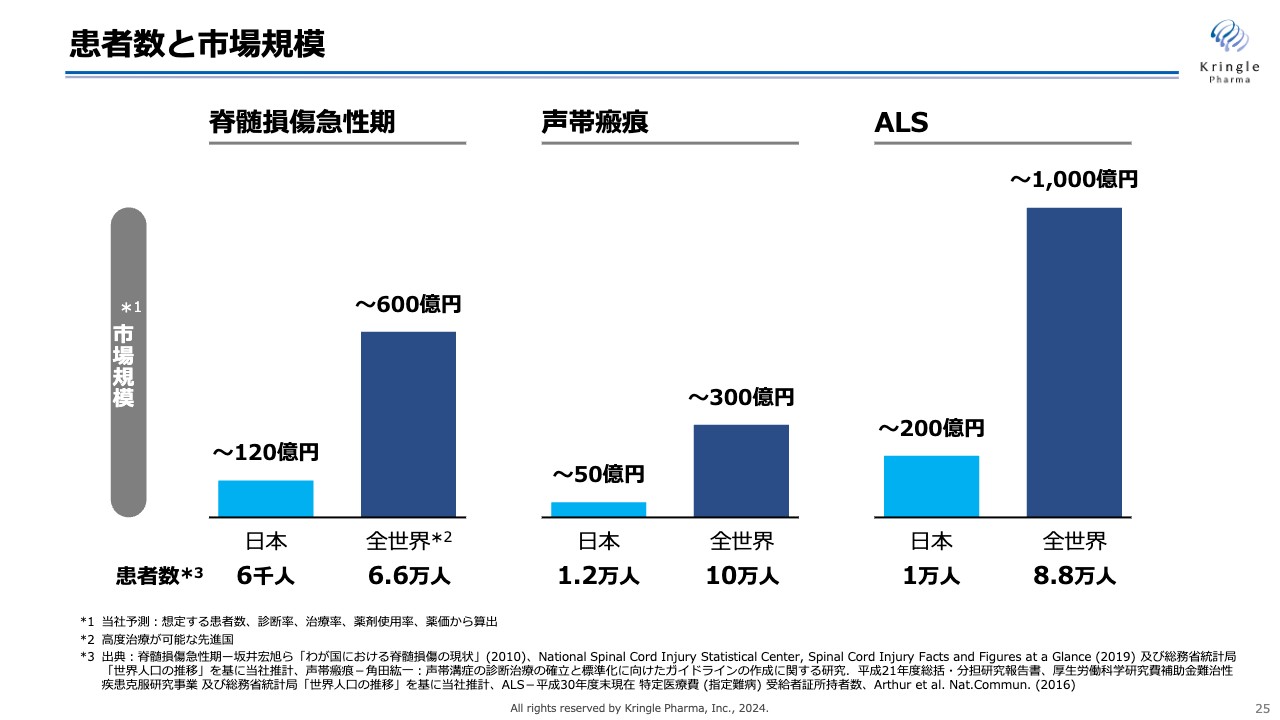
私たちの成長戦略には、「海外展開」と「適用拡大」の大きく2つがあります。
まずは海外展開について、当社が対象としている「脊髄損傷急性期」「声帯瘢痕」「ALS」はいずれも希少疾患です。そのため、スライドの青色のグラフをご覧のとおり、国内だけの患者数・市場規模を考えると限定的になります。しかしながら、海外は患者数が約10倍ですので、当然それに応じて市場規模も大きくなります。
ですので、今後当社が飛躍的に成長を遂げるには、いかに早く海外市場にリーチするかが重要になっていきます。特に、第1パイプラインの脊髄損傷急性期については、先ほどご説明したように、国内の2本の臨床試験で非常にポジティブなデータが得られていますので、現在はこれを使って米国での開発に乗り出しています。
HGF再生治療薬の適応拡大の可能性/全世界での対象患者数
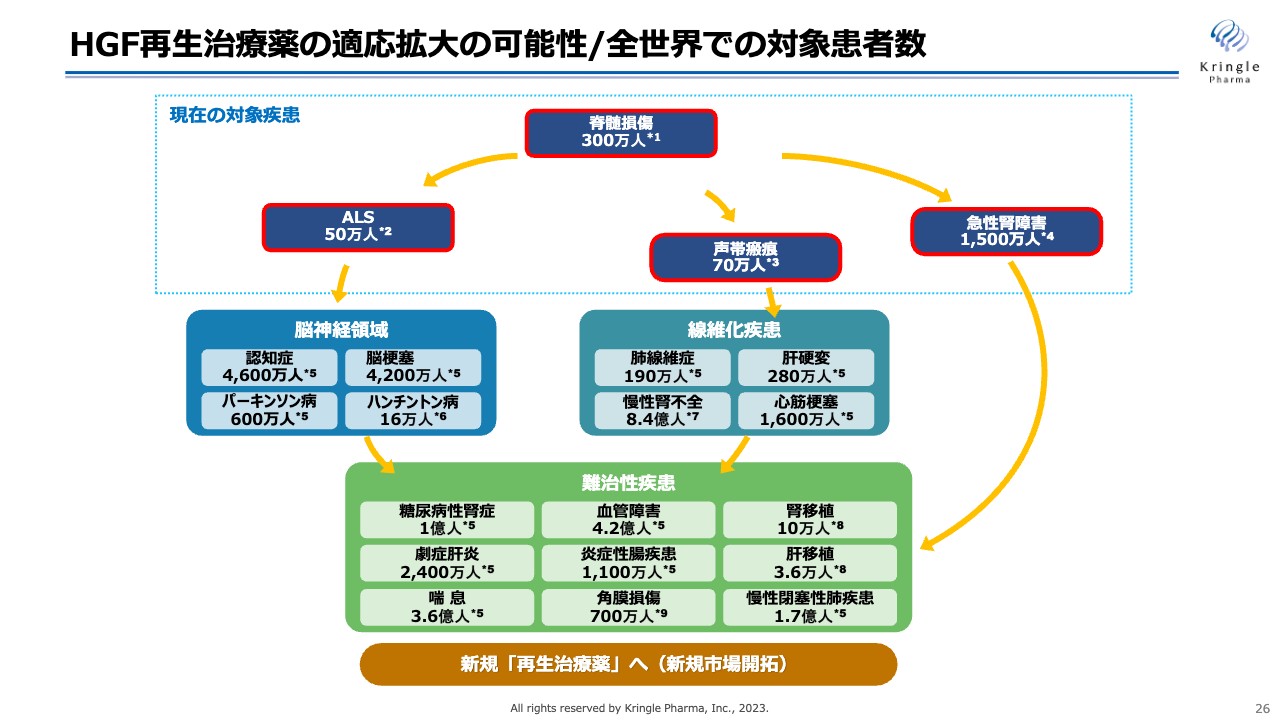
次に適応拡大です。HGFは再生治療薬としてさまざまな可能性があります。スライドには、これまで文献として、動物モデルで薬効が確認されている疾患を挙げています。当社が現在開発しているパイプライン以外にも、脳神経領域、線維化疾患、そのほかの難治性疾患でさまざまな可能性があります。
このような適応拡大をいかに迅速に進めていくか、HGFのポテンシャルをいかに最大化するかも、当社の今後の飛躍的な成長につながっていきます。
クリングルファーマの成長戦略
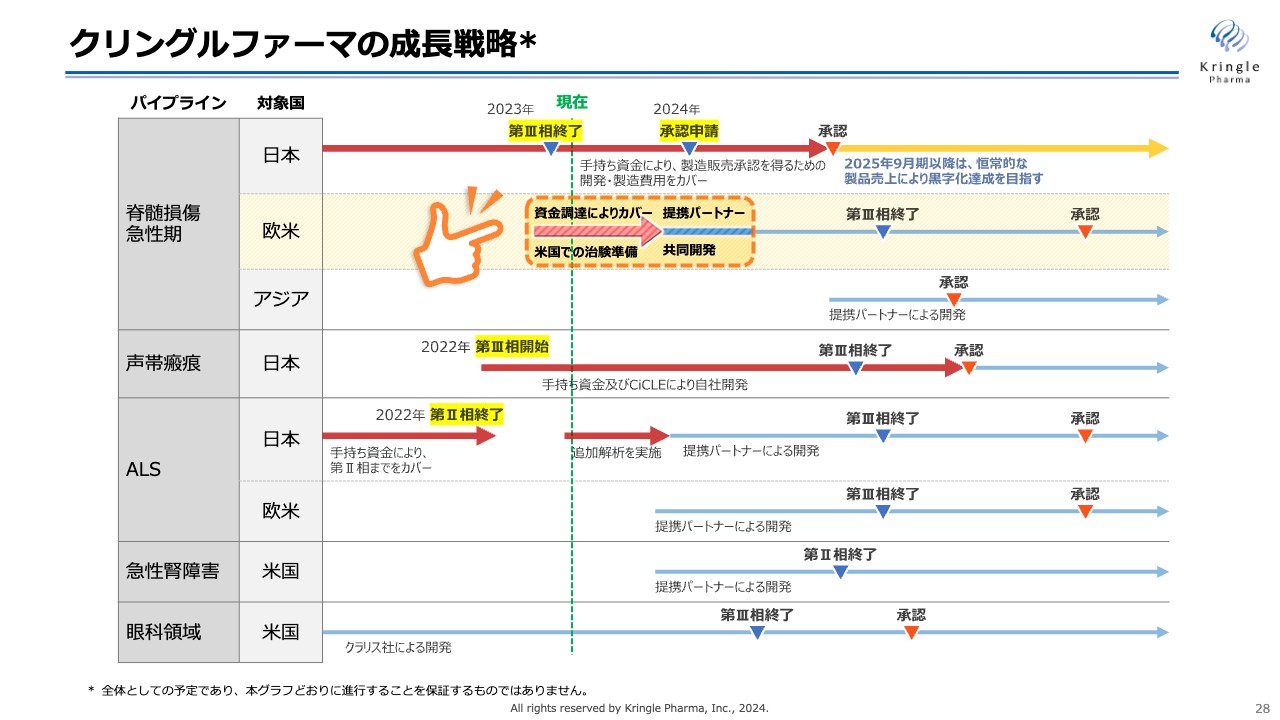
スライドでは、短い視点でもう少し具体的に、当社の成長戦略を示しています。一番重要なのは最上部の赤線、日本での脊髄損傷急性期の開発・承認を得るところです。2024年中に承認申請を行い、2025年9月期に承認を取得します。その後は恒常的な製品売上が発生し、これによって黒字化を目指します。
こちらのスケジュール感に変更はありません。承認を得るまでの開発費用も、すでに手持ち資金で確保しています。
脊髄損傷のパイプラインについては、現在資金調達により、米国での治験準備をスタートしています。これによって提携パートナーを得て、共同開発等のスキームで第Ⅲ相試験を行います。米国で試験を行い、承認を取得することで、全世界のグローバルスタンダードにしたいと考えています。
声帯瘢痕は、先ほどご説明したとおり、第Ⅲ相試験の症例の組入れを加速することにより、承認取得までを自社で行います。こちらも、手持ち資金およびAMEDのCiCLE事業を活用することで、資金を確保しています。ALSは追加解析をスタートしましたので、この結果をもって提携パートナーを得る方針です。
今後の成長戦略と資金調達の位置づけ
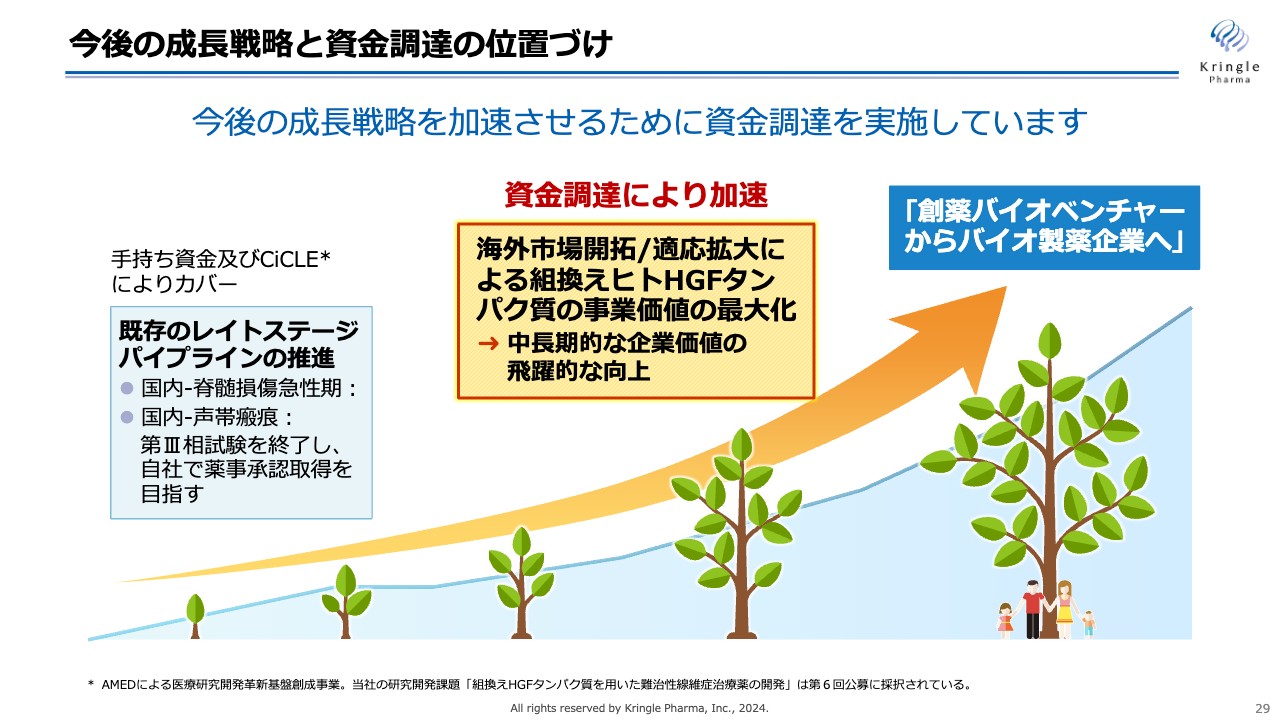
私たちは現在、脊髄損傷急性期および声帯瘢痕、2つのレイトステージパイプラインの推進を図っていますが、創薬バイオベンチャーからバイオ製薬企業へと成長するため、資金調達により積極的に海外展開/適応拡大を図っている状況です。
新株予約権発行による資金調達 進捗状況
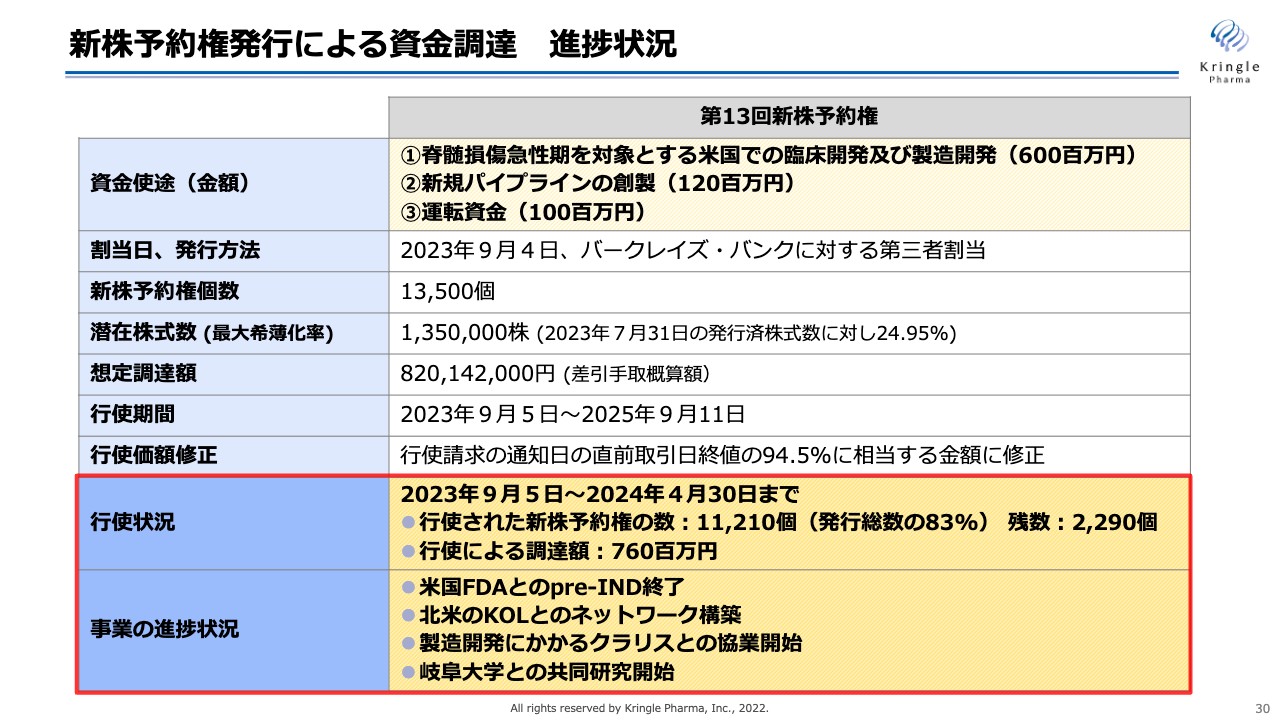
スライドは、現在進行中の資金調達の状況をまとめたものです。新株予約権をバークレイズ・バンクに割り当て、新株予約権の行使によって資金調達を進めるというスキームです。
4月末の状況としては、すでに新株予約権の約83パーセントの行使が終わっています。残数は2,290個で、もう少しというところまできています。4月末時点での調達額は7億6,000万円ですので、行使がすべて完了すると、8億円強から9億円くらいの資金調達になると考えています。
事業の進捗状況ですが、昨年11月に米国FDAとのpre-INDミーティングが終了しています。その結果に関して、北米のキーオピニオンリーダー(KOL)の先生方とネットワークを構築することもできました。
Web会議によってKOLの先生方からさまざまなアドバイスをいただき、現在はそれを反映し、米国での開発計画、プロトコールの策定を進めています。KOLの先生方は、私たちの国内のフェーズⅠ/ⅡおよびⅢの臨床試験データに非常に興味を持ち、有望だと言ってくださっています。
製造開発では、昨年9月にクラリス・バイオセラピューティクス(以下、クラリス社)との協業を開始し、粛々と共同作業を進めています。新規パイプラインの創製については、岐阜大学との共同研究を開始しました。
適応拡大の新たな可能性:大腿骨頭壊死症
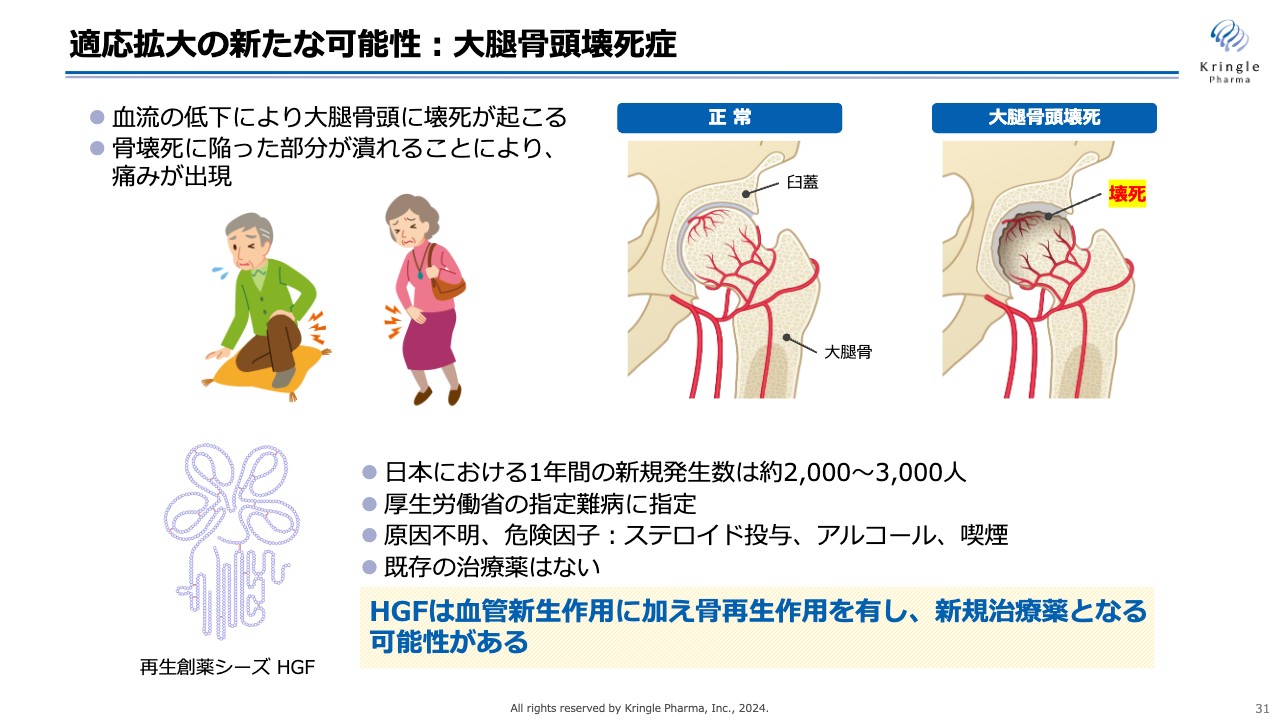
スライドのイラストは、共同研究の対象疾患である大腿骨頭壊死症です。大腿骨頭壊死症は、これまでの説明会では出てこなかった疾患です。
大腿骨頭壊死症では、血流低下によって大腿骨頭に壊死が起こり、その部分が潰れることで非常に激しい痛みが出てきます。ひどくなると歩けなくなりますし、立ったり座ったりすることも非常に苦しくなります。
現在日本では、1年間に約2,000人から3,000人の方が大腿骨壊死になると言われており、厚生労働省の指定難病にも指定されています。原因は完全にはわかっていませんが、危険因子としてステロイド投与、アルコール、喫煙などが挙げられています。この疾患についても、既存の治療薬がありません。
HGFには非常に強力な血管新生作用と、骨を再生する作用があります。このHGFが、大腿骨頭壊死の新しい治療薬になる可能性があるとのことで、岐阜大学の先生方と共同研究をスタートしました。
収益イメージ図
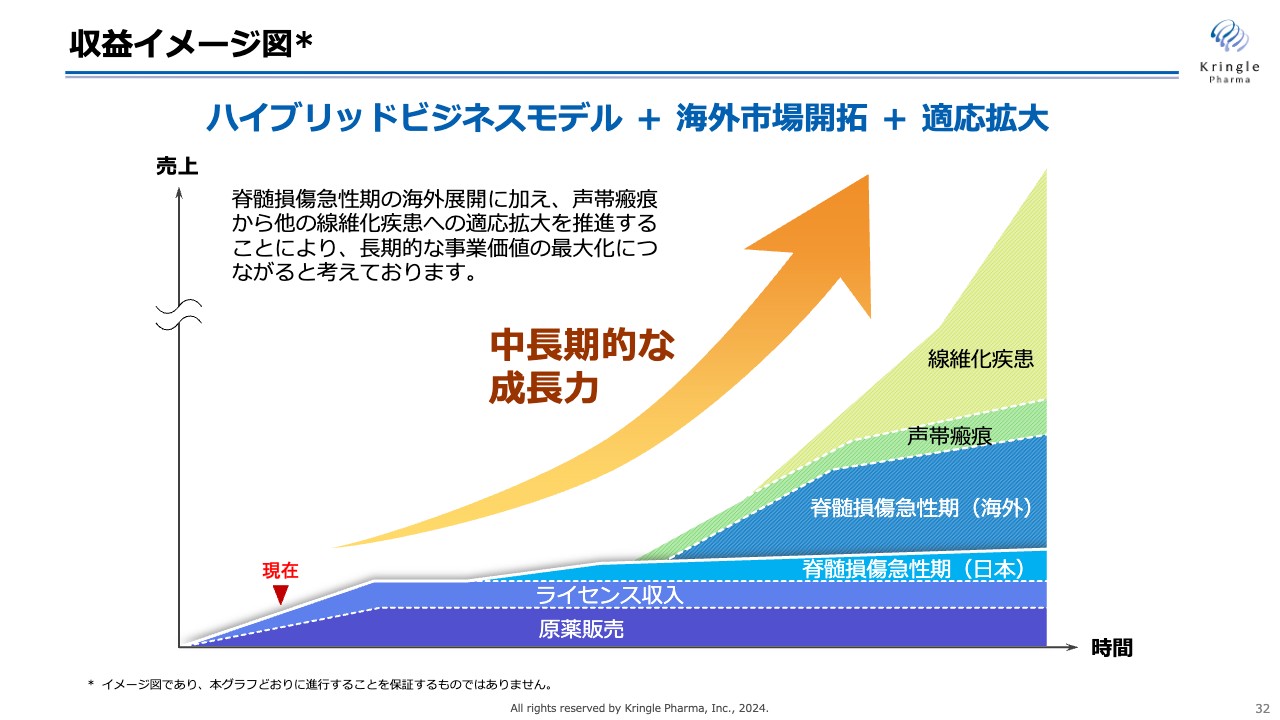
スライドは、当社の成長を図示したものです。まずは国内の脊髄損傷急性期で承認を取得し、海外でも承認を取ります。これによって、脊髄損傷急性期をグローバルスタンダードにし、声帯瘢痕から他の線維化疾患に適応を拡大していきます。
これを達成することで、グラフの矢印のように、中長期的かつ飛躍的な成長を遂げることを狙っています。
2024年9月期第2四半期 経営成績の概況
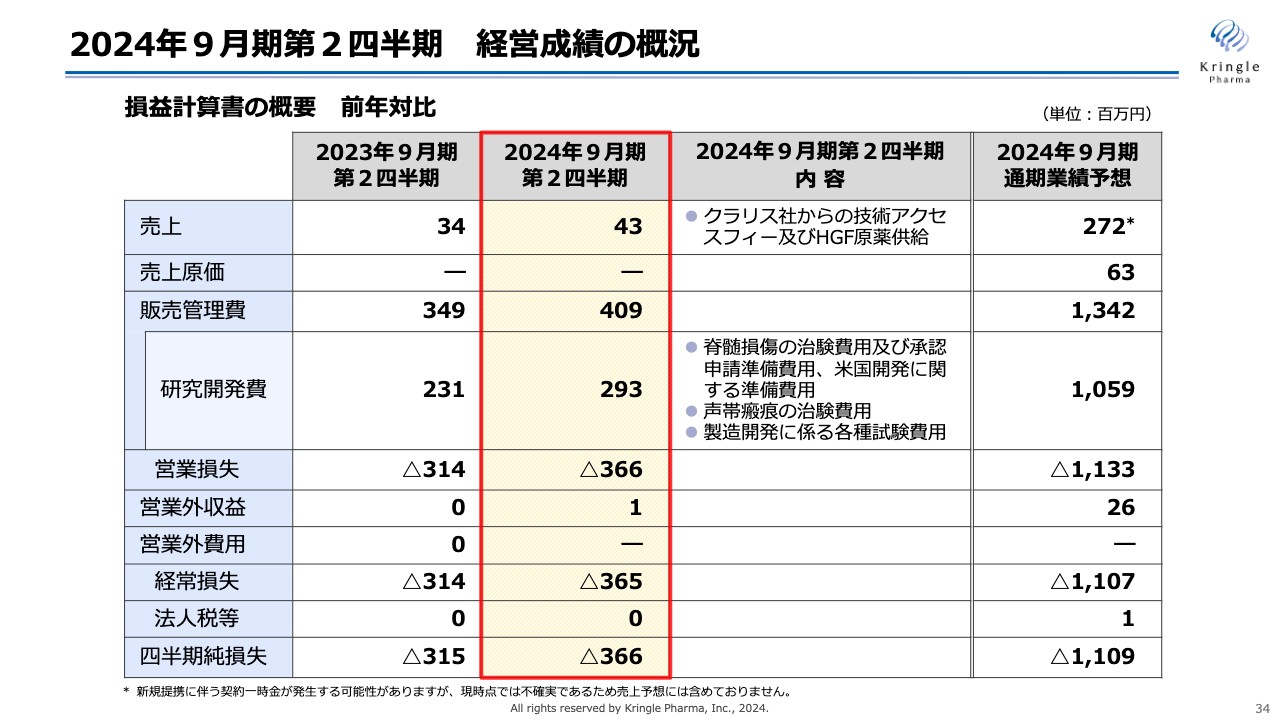
2024年9月期第2四半期の決算概況について、ご説明します。スライドは、損益計算書の概要を前年比で示したものです。
第2四半期の売上は4,300万円、こちらはクラリス社からの技術アクセスフィーおよびクラリス社へのHGF原薬供給に伴うものです。
販売管理費は4億900万円、そのうち研究開発費は2億9,300万円です。こちらには脊髄損傷の国内での申請準備費用、米国での開発準備費用、声帯瘢痕の治験費用、製造開発に係る各種試験費用が含まれています。
前年比で、営業損失はマイナス3億6,600万円、経常損失はマイナス3億6,500万円、四半期純損失はマイナス3億6,600万円となりました。
スライド右端に、今期通期での業績予想を示しています。第2四半期時点ではまだ半分まで達していませんが、下期に売上、あるいは研究開発費の多くを消費する予定にしていますので、概ね計画どおり進捗しています。
2024年9月期第2四半期 財政状態の概況
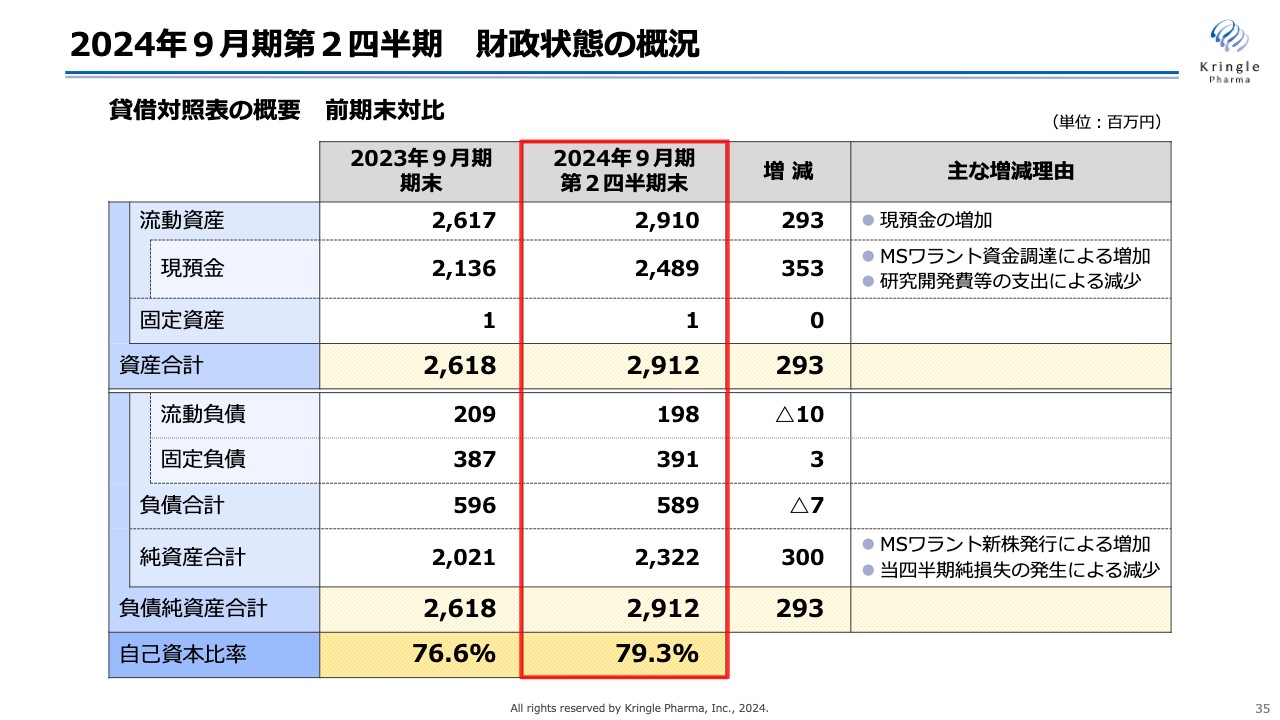
スライドは、貸借対照表の概要を前期末対比で示したものです。流動資産は29億1,000万円、うち現預金が24億8,900万円、資産合計は29億1,200万円です。
負債合計は5億8,900万円、純資産合計は23億2,200万円、合わせて29億1,200万円となっています。
自己資本比率は前期末の76.6パーセントに対し、3パーセント上昇して79.3パーセントと、引き続き安定的で健全な財政状態を維持していると思います。
2024年9月期第2四半期 キャッシュ・フローの状況
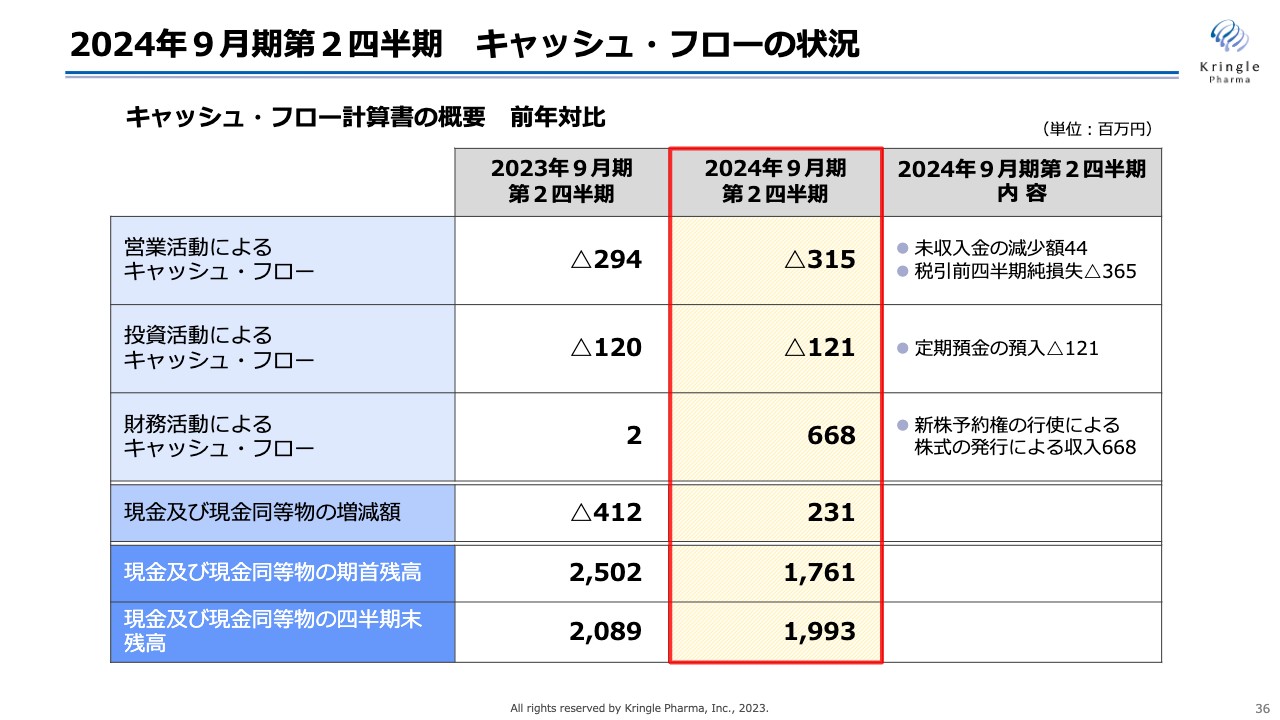
キャッシュ・フローです。営業活動によるキャッシュ・フローは、前年比マイナス3億1,500万円、投資活動によるキャッシュ・フローは、前年比マイナス1億2,100万円です。こちらはAMEDのCiCLEの事業に伴って、毎年定期預金を預け入れているものです。
前年対比で一番大きな差異は財務活動によるキャッシュ・フローで、第2四半期は6億6,800万円となっています。こちらは、先ほどお話しした新株予約権の行使による株式発行の収入によるものです。
以上を合わせて、現金および現金同等物の第2四半期末残高は19億9,300万円となり、国内の脊髄損傷、声帯瘢痕の開発を進めるのに十分なキャッシュを保持しています。
クリングルファーマのビジョン
クリングルファーマのビジョンは、「患者さんに新薬を、人々に笑顔を」届けることです。まずは脊髄損傷急性期に対して日本での承認を取り、日本だけではなく、米国を起点にグローバルでの医薬品開発に成功し、海外展開を図っていきます。
あわせて、HGFのさまざまな適応拡大を迅速に進め、最終的にはHGFの次のシーズの開発にも着手し、創薬ベンチャーからバイオ製薬企業への成長を目指します。ご清聴ありがとうございました。
質疑応答:脊髄損傷急性期の製造販売承認申請の状況について

司会者:「第1四半期の決算発表時に、脊髄損傷急性期第Ⅲ相試験のトップラインデータの速報発表と同時に、脊髄損傷急性期に関して、国内で製造販売承認申請を進めていくというご説明がありました。その後の状況はいかがでしょうか?」というご質問です。
安達:製造販売承認申請の前にPMDAとの協議があります。スライドに記載のとおり、大きくは事前面談、申請前相談という2つの面談が必要になります。
事前面談では、大まかな課題整理が行われます。その次に、承認申請における申請書類の具体的な内容を確認する申請前相談があります。
当社は現在、PMDAと事前面談を進めています。PMDAからの指摘事項に対応している状況のため、現時点では一つひとつ前に進めている途中だとお考えいただければと思います。
質疑応答:HGFタンパク質の製造状況について
司会者:「脊髄損傷急性期の承認申請に向けてのHGFタンパク質の製造状況について、教えてください。また、残された課題、品質面、体制の整備等はありますか? 他社で問題となった同等性の問題はありますでしょうか?」というご質問です。
安達:当社が開発しているのはHGFタンパク質というバイオ医薬品です。HGFタンパク質の製造については、承認申請のために実製造と同様のプロセスで行う、プロセスバリデーションと呼ばれる試験製造を3回行うことが要求されます。
原薬と製剤の両方について、当社はすでにプロセスバリデーションを終了しており、一番大きなハードルはすでに終わっています。承認申請の前には業許可を取る必要があるため、その取得に向けた社内体制、三役の配置の準備を進めているところです。
同等性・同質性について、HGFタンパク質製剤は、第Ⅲ相試験で使った治験薬と、今後、承認が取れて商用製剤として出ていく製剤の製造方法に変更がないため、特に問題にはならないと考えています。
質疑応答:声帯瘢痕のオーファン指定に関する申請について

司会者:「声帯瘢痕のオーファン指定に関して特に開示はありませんが、申請はされているのでしょうか?」というご質問です。
安達:声帯瘢痕のところでオーファン指定について述べなかったのですが、患者数を考えると、この声帯瘢痕はオーファン指定の対象となります。昨年、厚労省とオーファン指定の相談を行いましたが、申請には至っていません。
一方で2024年1月に、厚労省からオーファン指定制度における指定範囲拡大の通知が出ています。そこには、「命を脅かすような致死的な疾患だけでなく、生活の質(QOL)を著しく落とし、しかもその状態が長期的に続くような疾患も指定対象とする」といったことが明記されています。
まさに声帯瘢痕が該当するわけですが、当社としては、この声帯瘢痕の要件該当性は非常に高くなったと考えています。
さらに、関連学会で声帯瘢痕の診断基準が設定されようとしています。ですので、この設定を待ち、厚労省とオーファン指定に関する相談を再度行い、厚労省の了解を得た上で申請したいと考えています。
質疑応答:東北大学との共同研究の状況について

司会者:「先日、東北大学との共同研究として、ALS第Ⅱ相試験の追加解析を行うという開示がありましたが、状況はいかがでしょうか? また、追加解析の結果はいつ公表されるのですか?」というご質問です。
安達:ALSのご説明のところでもお伝えしましたが、今般、追加解析について東北大学と共同研究を開始するに至りました。この共同研究は、神経変性、神経炎症に関係する、バイオマーカーを測定するといった内容です。
ALSのバイオマーカーについては、特にニューロフィラメント軽鎖が注目されています。その経緯として、米国のバイオジェン社が開発していた「トフェルセン」という遺伝子治療薬の事例があります。「トフェルセン」は、第Ⅲ相試験の主要評価項目が未達であったにもかかわらず、ニューロンフィラメントの値が有意に動いたため、米国FDAが迅速承認を出しました。
このニューロフィラメントの動きをFDAが認めた、つまりバリデーションされたということで、最近ALSの治験では、二ユーロフィラメントを必ず測定することになっています。
東北大学との共同研究においても、ニューロフィラメント軽鎖を含めて複数のバイオマーカーを解析し、HGF投与と運動スコアの動きに何らかの相関が見られないかを検証します。それが、今回の共同研究の目的です。
この研究は東北大学が主体的に行うため、その進捗にもよりますが、今年度中には追加解析が終了すると思います。また、終了後は東北大学からの学会発表・論文発表とあわせて、当社からもリリースが出せればと考えています。
質疑応答:脊髄損傷急性期に関する米国での治験開始について

司会者:「脊髄損傷急性期に関する米国での治験開始に向け、FDAとの事前協議を行う準備を進めているとのことでした。その進展について教えていただけますか?」というご質問です。
安達:米国での開発は着々と進んでいます。スライドでご説明したとおり、昨年11月、FDAからpre-INDの回答を得ることができました。その内容を踏まえ、当社が行った日本でのフェーズⅠ/Ⅱ、そしてⅢの内容を、北米の専門医、キーオピニオンリーダーの先生方に見ていただき、協議を進めているところです。
先生方からは、非常にポジティブなコメントとアドバイスをいただいており、こちらを活用して、米国でより勝算の高いプロトコールを作ることに注力しているところです。
質疑応答:第Ⅰ/Ⅱ相試験の終了予定について
司会者:「クラリス社が米国で実施している第Ⅰ/Ⅱ相試験は、いつ終了する予定ですか?」というご質問です。
安達:今回のスライドでは、クラリス社について触れていませんでした。クラリス社は、当社から供給したHGFを使い、眼科疾患である神経栄養性角膜炎を対象に、米国とカナダで第Ⅰ/Ⅱ相試験を行いました。守秘義務があるため詳細はお伝えできませんが、この第Ⅰ/Ⅱ相試験ではすでに組入れが終了し、データ固定の作業を進めていると聞いています。
クラリス社のホームページには、トップラインデータをこの上期中に発表すると記載があるため、今しばらくお待ちいただければと思います。
質疑応答:新株予約権発行による資金調達について
司会者:「現在行われている第13回新株予約権発行による資金調達について、これまでの実績、実行中の内容、実行予定の内容、それぞれにかかる金額等を教えていただけますか?」というご質問です。
安達:4月末時点での調達額は、7億6,000万円です。新株予約権の残数が2,290個ということで、最終的には8億円後半から9億円くらいの資金調達になるかと思います。
資金使途としては、脊髄損傷急性期を対象とする米国での臨床開発および製造開発に6億円、新規パイプラインの創製に1億2,000万円、運転資金で1億円を考えており、こちらをカバーする資金調達は可能だと考えています。
ご説明したとおり、関連する事業は、主に米国が活動の場となります。スタートから半年強ですが、金額としてそこまで大きな費消にはなっていません。
質疑応答:脊髄損傷急性期が申請に進む可能性について

司会者:「脊髄損傷急性期に関して、申請のための事前相談を進めているとのことでした。申請前相談、申請に進む可能性をどの程度想定されていますか? また申請が難しい場合、どのような条件が提示される可能性が考えられますか?」というご質問です。
安達:おそらく多くの方が、この点について大きな関心を持っているのではないかと思います。PMDAとの協議における細かい内容は、申請に係る守秘条項となるため詳細は開示できませんが、途中で述べたとおり、事前面談でPMDAの指摘に対する対応を進めています。
最終的にPMDAからどのような回答が出るかについては、なかなか見えづらい部分がありますが、当社としては今回のフェーズⅢ、前相のフェーズⅠ/Ⅱと合わせて、重症度の異なる対象患者に改善傾向が認められているデータがあります。そのため、それをさまざまな角度、切り口で分析し、PMDA向けの資料を作っているところです。ハードルが高いとはいえ、承認申請には自信を持って進めています。
質疑応答:競争優位性について
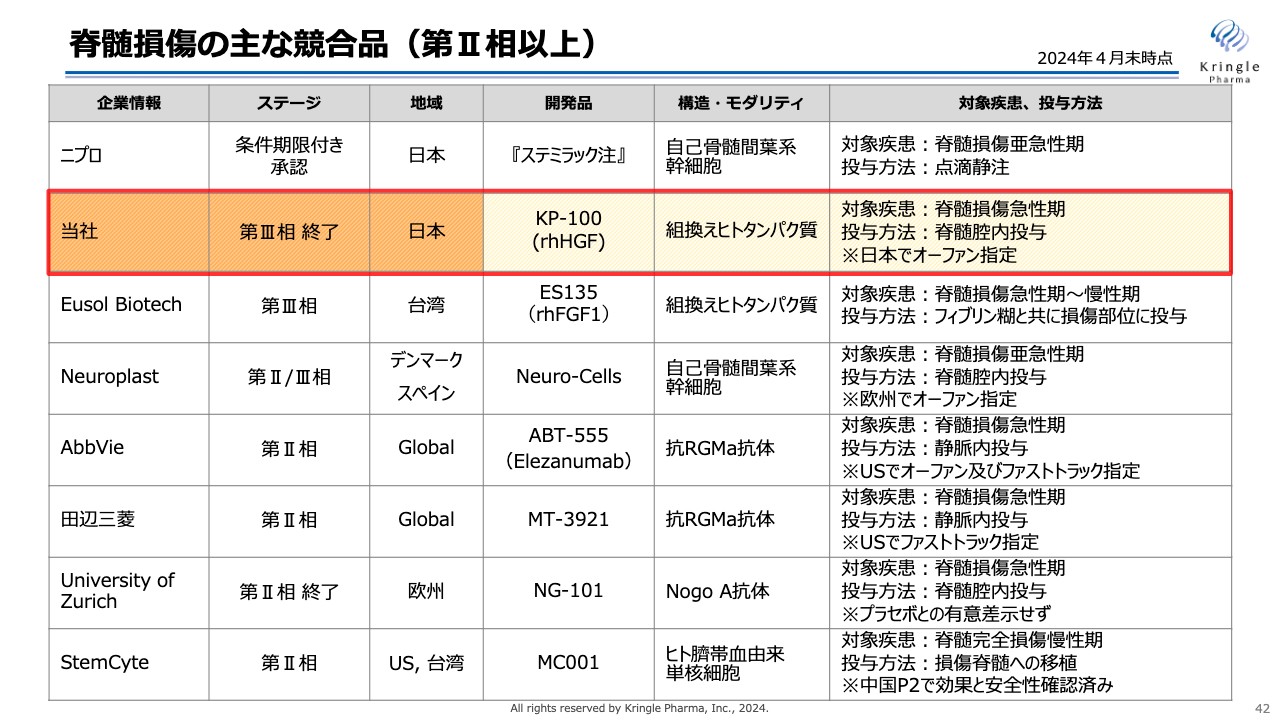
司会者:「HGFの開発を進めている企業が台湾にもあったと思いますが、御社の優位性について教えていただけますか?」というご質問です。
安達:スライドに、脊髄損傷の主な競合品を記載しています。上から3番目のEusol Biotechは台湾の会社です。脊髄損傷に対して、FGFという別の生体内タンパク質の組換えタンパク質の第Ⅲ相試験を実施していることが、同社のホームページあるいはデータベース等でも確認できます。
Eusol Biotech社のホームページをフォローしていますが、何年もアップデートされていない状況です。ですので、実際にどのくらいアクティブに動いているのかの情報は得られていません。
一方で、当社のHGFについては、日本における第Ⅲ相臨床試験がすでに終了し、実際に患者への効果が確認できています。またFGFよりHGFのほうが、特に急性期では二次損傷を抑える働きが強いと考えています。HGFのマルチな働きはFGFよりも効果が高いと考えているため、優位性は私たちのほうにあるのではないかと思います。
また、Eusol Biotech社の現在のフェーズⅢは、急性期だけでなく慢性期もターゲットにしています。しかしながら、脊髄損傷は時間とともに刻々と病態が変化します。そのため、患者のバラエティが非常に大きくなります。
したがって急性期だけでなく、亜急性期、慢性期もトータルで患者を組入れて、しっかりとした結果が出るのかどうか、甚だ疑問なところです。
質疑応答:人材の確保と育成について

司会者:「バイオ製薬企業になるにあたり、人材確保・育成が重要になってくると思いますが、今後どのように確保・育成していこうと考えていますか?」というご質問です。
安達:非常に重要なポイントだと思います。当社がバイオ製薬企業へと成長していくためには、当然ながら人材が重要な要素となります。創薬業界は、新卒の方がすぐに即戦力になるのは難しい部分があります。
現在、製薬企業には、「大企業ではなくベンチャーでもう一度活躍したい」という、リタイアに近いような方が多数います。
私たちも、そのような方を何名か採用した実績があります。経験や実績がありますし、新しいことに挑戦しようという意欲的な方がいるため、今後もそのような人材を確保していきたいと考えています。
同時に、若手の育成が大変重要になってくるため、経験豊富なシニアの方を採用するだけでなく、若い方も採用し、教育しながらバランスのよい体制にしていきます。それが、バイオ製薬企業へと成長する上で必要なことだと考えています。
質疑応答:海外の脊髄損傷に関するパートナーと今後のスケジュールについて

司会者:「脊髄損傷急性期について、欧米における共同開発のパートナーは、現在探しているところという理解でよいですか? また、欧米での第Ⅲ相試験の開始時期や申請時期など、開発の今後のスケジュールで決まっていることがあれば教えてください」というご質問です。
安達:海外の脊髄損傷に関するパートナーリングについては、現在積極的に進めているところです。秘密保持契約のもとで、すでに複数の会社とお話ししています。詳細は、契約成立まで開示できませんが、着々と進んでいるとご理解ください
6月の初めには、米国で「BIO International Convention 2024」という非常に大きなビジネスミーティングのカンファレンスがあります。当社はそちらに参加して、積極的に活動していきたいと考えていますので、ご期待いただければと思います。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4884
|
375.0
(11:30)
|
-20.0
(-5.06%)
|
関連銘柄の最新ニュース
-
クリングル(4884) 2026年9月期第1四半期決算レポート更新... 03/03 12:10
-
クリングル(4884) 第三者割当により発行された第16回新株予約... 03/02 10:00
-
クリングル(4884) 「2026年9月期 第1四半期決算説明」の... 02/16 11:40
-
クリングルファーマ、米国子会社Kringle Pharma USA... 02/16 11:00
-
クリングル(4884) 個人投資家向けIRセミナー【バイオ IR ... 02/12 11:00
新着ニュース
新着ニュース一覧-
今日 12:05
-
今日 12:04
-
今日 12:01
-
今日 12:01

