【QAあり】クリングルファーマ、脊髄損傷急性期第Ⅲ相試験の患者の経過観察が終了、薬事承認申請に向けて大きな進捗
アジェンダ

安達喜一氏(以下、安達):みなさま、本日は2023年9月期通期決算説明会にお集まりいただき、誠にありがとうございます。クリングルファーマ株式会社代表取締役社長の安達喜一です。
本日のアジェンダです。はじめに、2023年9月期のトピックス、開発パイプラインの進捗状況、脊髄損傷急性期、声帯瘢痕、ALSについてお話しし、その後、成長戦略、2023年9月期通期決算概況、2024年9月期業績予想についてご説明します。よろしくお願いします。
会社概要

会社概要です。当社は2001年12月に、大阪大学・慶應義塾大学発創薬バイオベンチャーとして設立されました。企業理念に、「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」と掲げています。
当社は現在、国産の再生創薬シーズであるHGF(肝細胞増殖因子)の医薬品開発に注力をしています。肝細胞の「肝」は肝臓の肝です。もともとは肝臓の再生、肝臓の細胞を増殖させるタンパク質として日本で発見されました。
スライド左側には、このタンパク質の2次構造を模式的に表しています。HGFは非常に複雑な構造を持つタンパク質です。692個のアミノ酸が数珠状につながっており、19個の分子内架橋によって複雑な立体構造を保っています。
このタンパク質は誰もが体の中に持っているものですが、HGFが足りないがゆえに、病気が悪化・進行してしまう状況に対して、HGFを外から補ってあげるのがHGFの医薬品開発のコンセプトです。
HGFは、もともと細胞を増殖させるタンパク質として見つかりましたが、その後の研究で、さまざまな生物学的機能を持つことがわかっています。細胞を保護する働き、あるいは抗繊維化の働き、血管新生、形態形成といったマルチな生物学的機能を併せ持っています。
対象とする臓器も肝臓だけではなく、体中のさまざまな組織や臓器が傷を負った時に、それを治すために体が作るタンパク質であることがわかっています。
当社の特徴の1つは、複雑なタンパク質であるHGFを、遺伝子操作の技術を用いて組換えタンパク質として、かつ医薬品グレードで製造する体制をすでに構築していることです。
2023年9月期のトピックス(後発事象を含む)

2023年9月期のトピックスは3つあります。1つ目に、当社のレイトステージの開発パイプラインで、非常に大きな進捗を得ることができました。第1パイプラインの脊髄損傷急性期については、2023年10月に第Ⅲ相試験の患者の経過観察が終了しました。
第2パイプラインの声帯瘢痕については、2023年1月に、第Ⅲ相試験の最初の患者の組入れを終了し、2023年5月には全国の5専門施設で患者の組入れを開始しました。
2つ目に、当期は臨床開発だけではなく、慶應義塾大学との共同研究で行っている脊髄損傷に対するHGFとiPS細胞の併用治療に関する研究について、非臨床試験でも非常に大きなマイルストーンを達成することができました。
動物モデルにおいて、慢性期の脊髄損傷に対してHGFとiPS細胞とスキャフォールドを合わせて投与することによって、ラットのモデルで劇的な治療効果が観察されました。
また、急性期にHGFを投与し、亜急性期にiPS細胞を投与する併用療法についても、ラットのモデルで劇的な効果を得ることができました。これらに関しては、特許を出願するとともに国際雑誌に論文が掲載されています。
3つ目に、当社の成長戦略にも直結しますが、今後、海外展開を積極的に進めるために、新株予約券を発行し、2023年9月から資金調達をスタートしています。
各項目については、後ほど詳細をご説明します。
開発パイプラインの概要

開発パイプラインの進捗状況についてご説明します。当社では4つの臨床段階にあるパイプラインを有しています。
第1パイプラインの脊髄損傷急性期については、現在、第Ⅲ相試験が終わりに近づいていますが、2023年10月に最後の患者の経過観察が終了しています。第2パイプラインの声帯瘢痕については、先ほどお話ししたように、2023年1月に最初の患者の組入れが終了しています。
第3パイプラインのALSについては、第Ⅱ相試験を医師主導治験として終了し、現在、追加解析を実施するべく、東北大学と協議を進めています。
第4パイプラインの急性腎障害は、第Ⅰ相試験をアメリカで終了し、第Ⅱ相試験を行うためのパートナーを探索しているところです。
クリングルファーマの成長戦略

今後の計画についてご説明します。第1パイプラインの脊髄損傷急性期の国内での開発については、2024年の薬事承認申請を目指して準備を進めています。2025年9月期に薬事承認と薬価収載を経て、製品売上を開始したいと考えています。これにより恒常的な製品売上が見込めますので、黒字化を達成していきたいと考えています。
また、欧米での開発に関しては、先般、資金調達のアナウンスをしましたが、具体的にはアメリカでの治験準備を開始しました。すでに海外の製薬企業、バイオ企業と提携の交渉を進めていますが、アメリカでの具体的な治験準備、FDAとの交渉状況を踏まえて、さらに交渉を加速していきたいと考えています。
第2パイプラインの声帯瘢痕については、現在、5施設で患者の組入れを継続しています。2024年後半に組入れを終了、 2025年後半に経過観察の終了を目指しています。
第3パイプラインのALSについては現在、追加解析を計画しています。東北大学と協議を進めており、今期中には追加解析を実施したいと考えています。この結果をもって、提携パートナーを得る方針です。
開発パイプライン-脊髄損傷急性期-

第1パイプラインの脊髄損傷急性期についてです。脊髄損傷は、転倒や事故などで脊髄に障害が起こる疾患です。国内では年間約5,000人が新たに脊髄損傷になると言われています。
現在、脊髄損傷急性期には薬剤がありません。手術等で骨を修復する治療はできますが、積極的に脊髄損傷を回復させる薬剤はなく、患者はもとより介護されるご家族の負担が非常に大きいため、医療経済効果の高い疾患です。
脊髄損傷急性期にHGFに期待する治療効果
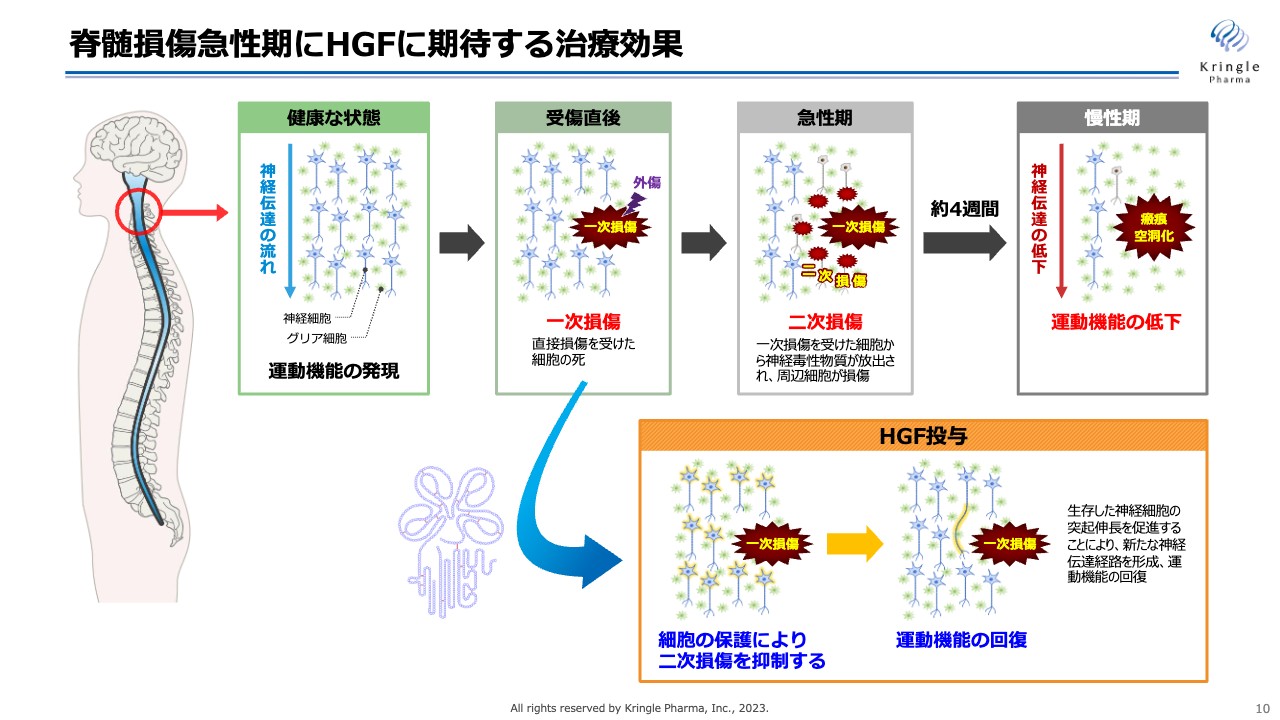
脊髄損傷急性期にHGFに期待する治療効果をまとめています。脊髄損傷は、急性期から亜急性期、慢性期と、刻々と病態が変化していきます。急性期には、最初の損傷部位の一次損傷から、周りの細胞にさらに損傷範囲が広がる「二次損傷」と呼ばれる現象が多く起こります。
慢性期になると、この二次損傷も含めた損傷範囲が瘢痕空洞化して、神経伝達が上から下に伝えられなくなり、運動機能が低下します。HGFには、この二次損傷を抑えることを期待しています。
HGFには細胞の保護、炎症反応の抑制、血管新生などのマルチな働きがあります。この働きにより、二次損傷をできるだけ抑えることで、患者の運動機能の予後を期待しています。
脊髄損傷急性期 第Ⅰ/Ⅱ相試験の結果

第Ⅰ/Ⅱ相試験として、プラセボ対照二重盲検比較試験をすでに終了しています。HGF投与群28症例、プラセボ投与群17症例を比較して、安全性に大きな問題はなく、有効性については非常にポジティブな結果を得ることができました。
スライド左下のグラフは、「ASIA motor score」(運動機能スコア)を、プラセボ群とHGF群で比較しています。6ヶ月の横軸経過観察期間にわたり、濃い青色で記したHGF投与群は高い運動機能のスコアを獲得しています。Day140では、統計的な有意差も得られています。
右側のグラフは、重症度Aに限定した部分集団解析です。重症度AからB、あるいはAからCに改善したものに色をつけてお示ししています。
プラセボ群でも、AからCの2段階改善割合が6.3パーセント見られますが、これは自然回復です。HGFを投与した群では、その4倍以上にあたる26.7パーセントで、AからCの2段階改善が見られました。
このようなポジティブな結果を踏まえて、2019年9月には、厚生労働省から希少疾病用医薬品指定(オーファン指定)を受けることができました。
日本のオーファン指定品目の上市確度は高い

日本のオーファン指定には、3つの指定基準があります。1つ目に国内における対象者数が5万人未満であること、2つ目に医療上の必要性が高いこと、3つ目に開発の可能性が高いことです。3つ目は、日本独自の要件で、臨床試験での安全性・有効性のデータが求められます。
逆に言うと、日本でオーファン指定を受けると、その後、医薬品として上市する確度が非常に高くなることがデータとしても示されています。
スライド下部の円グラフは、2004年4月から2016年3月にオーファン指定された213品目の開発状況です。65.7パーセントが承認を受け、残り30.5パーセントが開発中、指定が取り消されたものが3.8パーセントとなっています。
当然ながら、開発中でもその後に承認が取れたものもありますが、トータルで見ると70パーセントから80パーセントの確度で上市されると言っても過言ではありません。
オーファン指定を取るとさまざまなメリットがありますので、このようなメリットを享受して、脊髄損傷急性期の開発を進めているところです。
脊髄損傷急性期 第Ⅲ相試験(医薬品開発の最終段階)

現在進めている第Ⅲ相試験の概要についてご説明します。この試験は、多施設共同非ランダム化試験であり、HGF投与群のみからなる試験です。また、目標症例数が25症例と非常に小規模の試験となっています。
対象患者は、頚髄損傷で最も重症な、重症度Aの患者です。用量・用法は前相と同じで、週1回の脊髄腔内投与を5回繰り返して、6ヶ月間経過を観察します。主要評価項目は、6ヶ月後に重症度C以上に改善した症例割合となっています。
この試験は、2020年7月から患者の組入れをスタートし、2023年4月にようやく組入れを完了しました。まさにコロナ禍のまっただ中で行われた試験で、医療上大変厳しい状況の中、患者とそのご家族はもちろんのこと、試験施設の先生方やスタッフのみなさまの多大なる協力を得て、患者の組入れを終えることができました。
今後の計画としては、2024年に総括報告書を取りまとめますが、その前に速報として、試験結果を開示したいと考えています。
脊髄損傷急性期 薬事承認後のサプライチェーン

脊髄損傷急性期のプログラムは、当社が自社で薬事承認を取得します。スライドに記載しているとおり、承認取得後のサプライチェーンもすでに構築されています。当社が製造販売元、急性期医療のスペシャリティーファーマである丸石製薬社が販売元、医薬品卸の大手である東邦ホールディングス社が卸売・流通を担うかたちで、最終的に全国の救急病院に医薬品が届けられる仕組みです。
開発パイプライン-声帯瘢痕-

第2パイプラインの声帯瘢痕についてです。声帯は喉の奥にある非常にデリケートな構造を持った器官で、両側の声帯が高速に振動することで声が出ます。声帯がなんらかの原因で線維化して硬くなってしまうと、声帯がきちんとバイブレーションせず、声が出にくくなり、ひどくなると声が出なくなってしまう難病です。
患者数は、日本では3,000人から1万2,000人と言われています。有効な治療薬・治療法は現在まったく存在せず、アンメット・メディカル・ニーズ(Unmet Medical Needs)が高い希少疾患です。
声帯瘢痕に対するHGFの作用機序
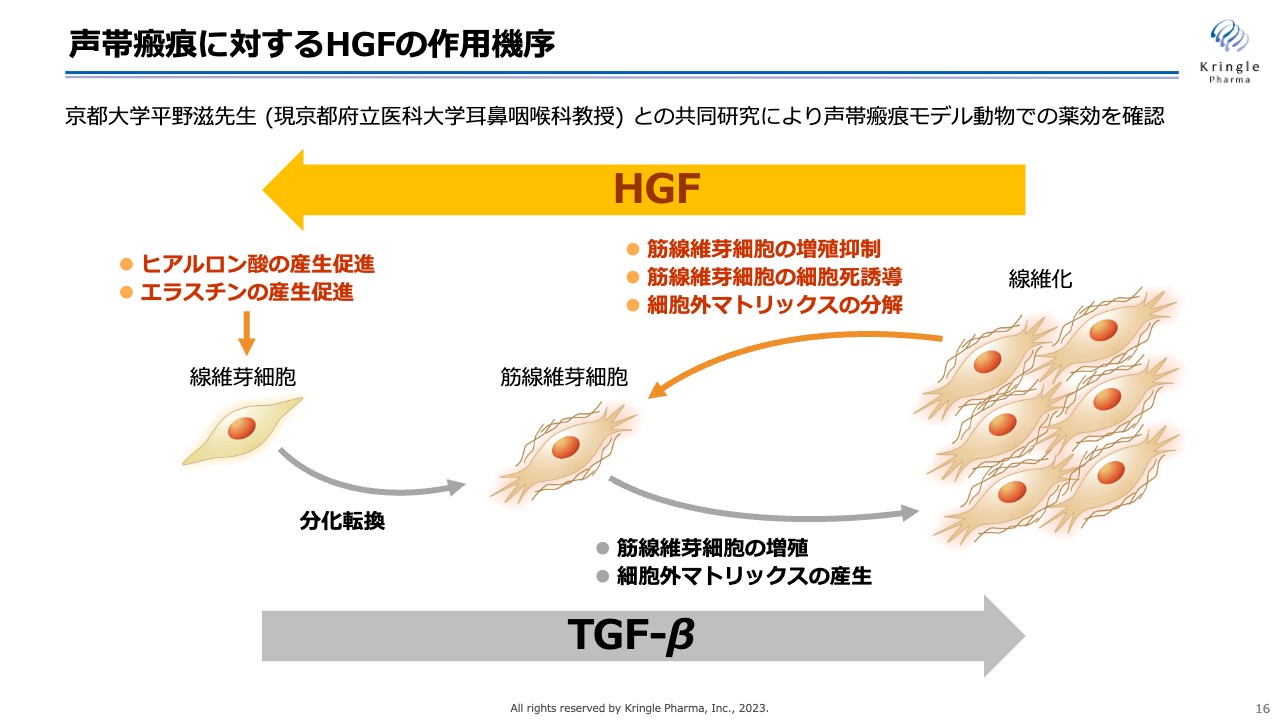
声帯瘢痕は線維化疾患の一種です。線維化疾患はスライドの図のように、線維芽細胞が筋線維芽細胞に分化して、コラーゲンのような細胞外マトリックスをたくさん産生することで、線維化が進んでいきます。
これにはTGF-βという生体内のタンパク質が関わっていることがわかっています。HGFには、スライドのように右から左へと、線維化を解除する働きがあります。
グロースファクター(増殖因子)は体の中に多数ありますが、このような線維化を解除する働きがあるのは、HGFの非常にユニークな特徴の1つです。
声帯瘢痕 第Ⅰ/Ⅱ相試験の結果
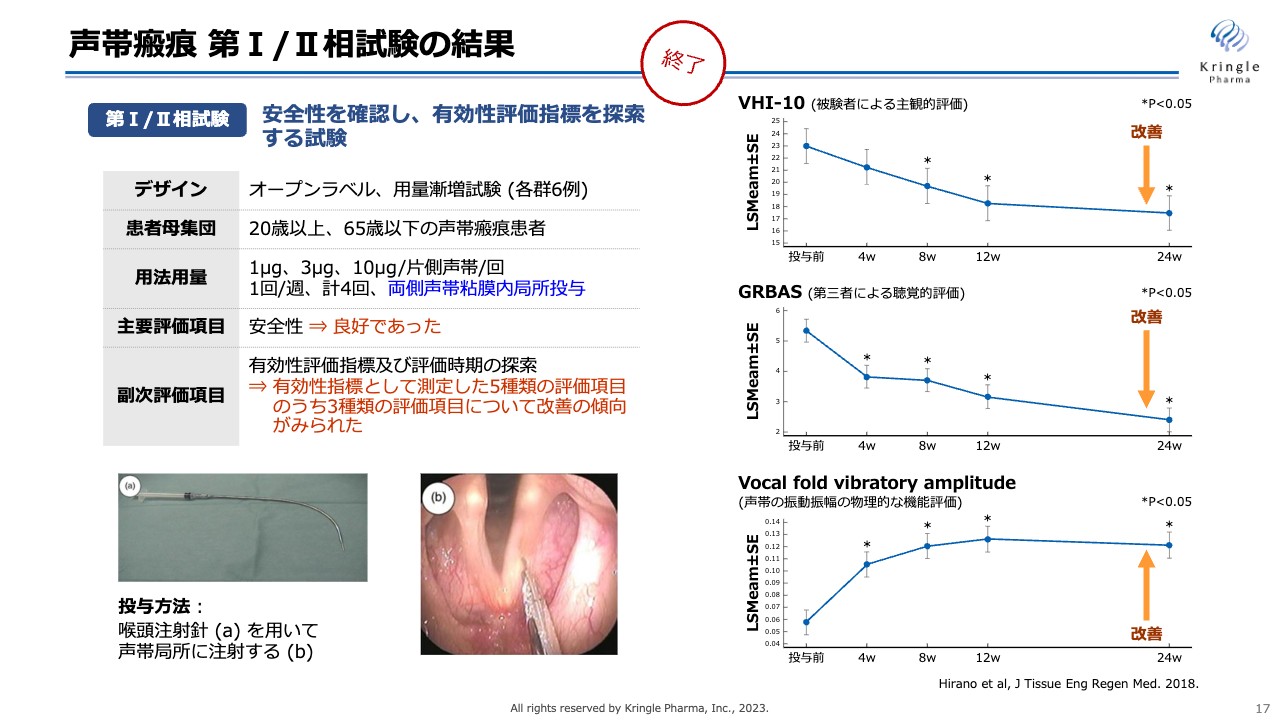
当社は京都府立医科大学の平野教授と共同で、すでに第Ⅰ/Ⅱ相試験を終了しています。この試験はオープンラベルの試験で、3用量で試験しています。スライド下部に声帯の写真がありますが、この声帯の両側に長い注射針を使って、HGFを微量注射します。週1回の投与を4回繰り返して、6ヶ月経過を観察する試験です。
結果として、スライド右側にある3つの指標で改善傾向であることが示されています。被験者による主観的評価「VHI-10」、第三者による聴覚的評価「GRBAS」、声帯の振動振幅の物理的な評価の3つの異なる指標で、それぞれ改善傾向が認められており、非常にポジティブに捉えています。
声帯瘢痕第Ⅲ相試験(医薬品開発の最終段階)

現在、第Ⅲ相試験を実施中ですが、先の第Ⅰ/Ⅱ相試験がオープンラベルの試験だったため、第Ⅲ相試験はプラセボ対照二重盲検比較試験として実施しています。
目標症例数は62症例で、HGF群及びプラセボ投与群、各群31症例です。二重盲検期としては週1回の投与を4回繰り返し、6ヶ月観察します。その後、さらに継続投与期を設けて、最長1年間まで患者にご協力いただくことになっています。
主要評価項目は、先ほどお示しした被験者による主観的評価「VHI-10」のスコアになります。現在、国内の5施設で患者の組入れを進めており、2024年後半に組入れを終了し、2025年後半に最終症例の経過観察を終了する予定です。
開発パイプライン-ALS-

筋萎縮性側索硬化症ALSは神経難病の象徴的な疾患で、現在国内では約1万人がALS患者だと言われています。運動神経が選択的に脱落していきますので、徐々に体が動かなくなっていき、最後は呼吸することができなくなり死に至るという非常に過酷な疾患です。
既存薬もいくつかありますが、まだ効果が限定的です。引き続き、効果のある薬が望まれている医療経済効果の高い疾患です。
ALS 第Ⅱ相試験(医師主導治験)

当社は東北大学の青木教授と共同で、第Ⅱ相試験として医師主導治験を実施しました。プラセボ対照二重盲検比較試験として行いましたが、主要評価項目あるいは副次項目では、統計的な有意差は認められませんでした。
ただし、実薬を投与した群で進行が遅くなった症例もあり、現在バイオマーカーの評価を中心に追加解析の実施を考えており、東北大学と協議を進めています。こちらについては東北大学の倫理委員会ですでに承認が下りたため、いよいよ具体的な試験計画を詰める最終段階に入っています。
患者数と市場規模
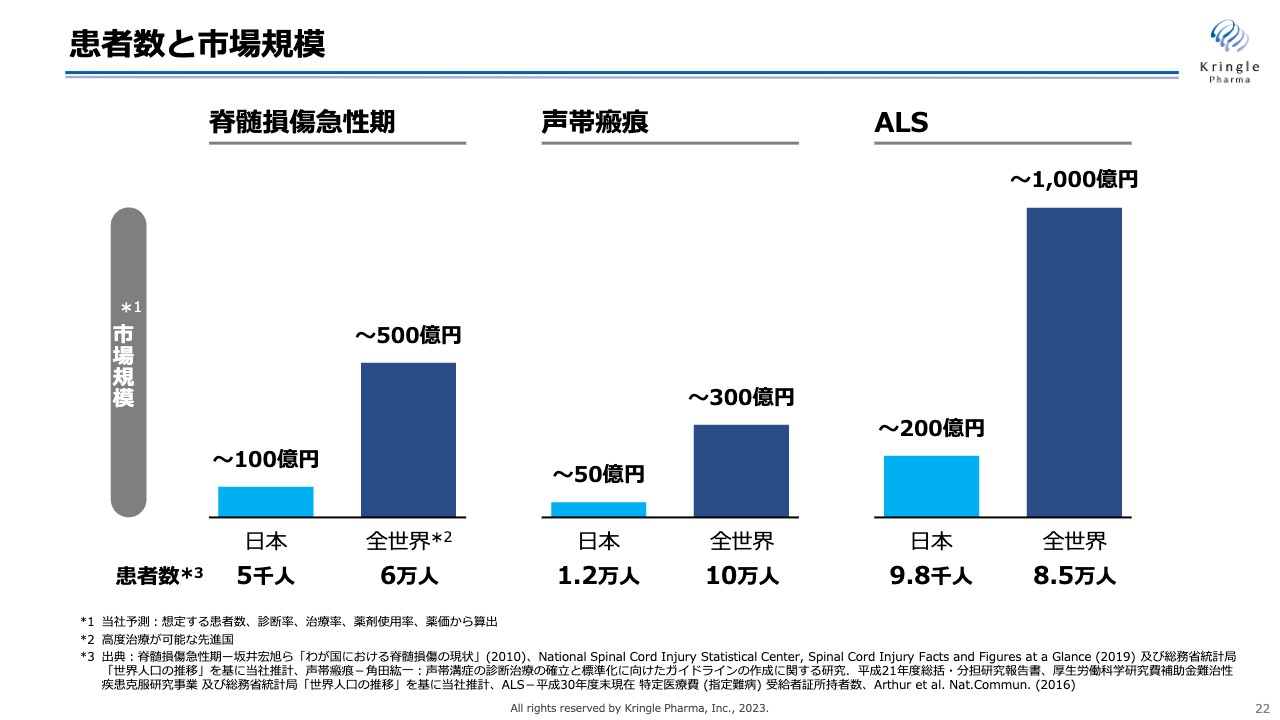
成長戦略についてご説明します。スライドは、いつもお示ししている当社のパイプラインの患者数と市場規模です。脊髄損傷急性期、声帯瘢痕、ALSはいずれも希少疾患ですので、国内のみを見ると患者数・市場規模も限られます。しかし、世界に目を向けると患者数は10倍以上となり、スライドの濃い青色の棒グラフでお示ししているとおり、グローバルでは相応した市場規模となります。
当社は、これまで国内での開発に力を入れてきましたが、HGFに人種差はありませんので、日本のみならず、グローバルな医薬品になるポテンシャルがあります。したがって、早期に海外の大きな市場にリーチするかが、今後の成長戦略において非常に重要なポイントとなります。
今後の成長戦略と資金調達の位置づけ

当社は現在創薬バイオベンチャーですが、スライドにお示ししている木の成長のように、最終的にはバイオ製薬企業へと成長していきたいと考えています。
既存のレイトステージパイプラインとして、国内の脊髄損傷急性期、声帯瘢痕ともに第Ⅲ相試験を終了し、自社で薬事承認を取るべく手持ち資金と補助金を確保しています。
先ほどお伝えしたように、今後の成長戦略上、海外市場開拓や適応拡大によって、組換えヒトHGFタンパク質の事業価値を最大化することが中長期的な企業価値の向上に資すると考え、今般、資金調達を開始したところです。
資金調達 行使価額修正条項付新株予約権の発行
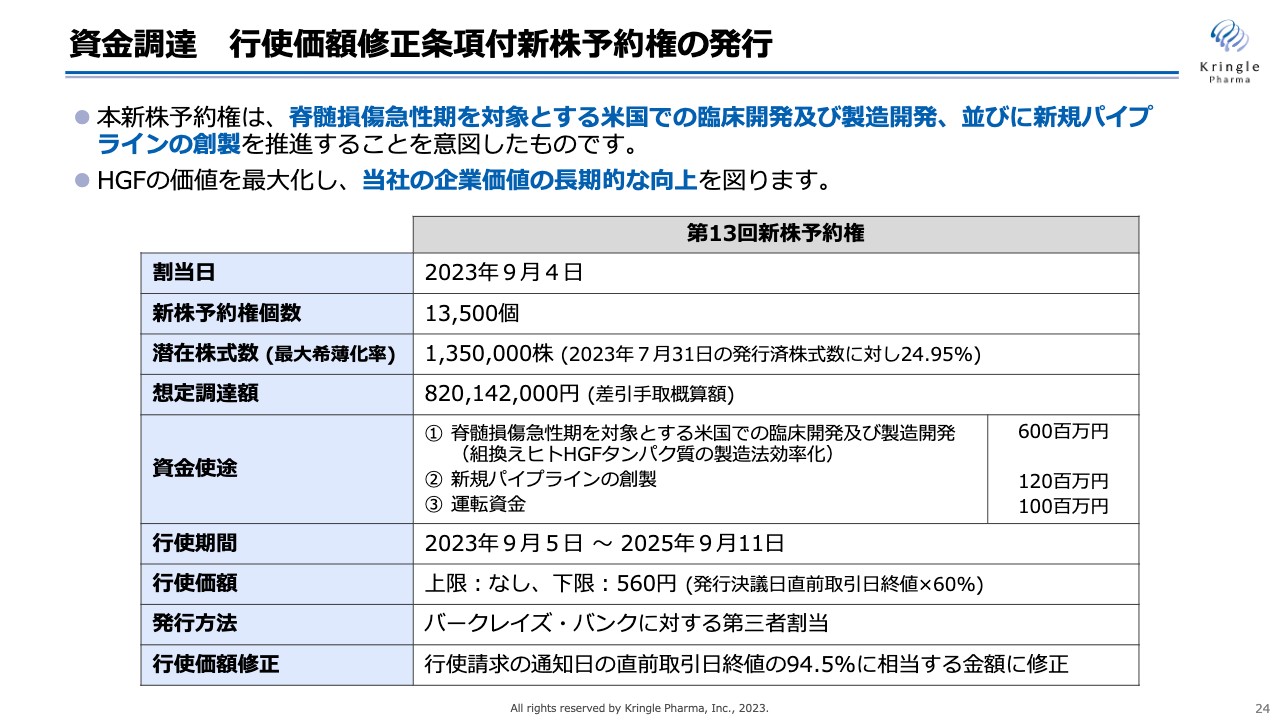
現在行っている資金調達の概要をお示ししています。行使価額修正条項付新株予約権を発行する資金調達であり、バークレイズ・バンクに新株予約権を割り当て、バークレイズ・バンクが今後2年間にわたり新株予約権を行使し、その都度、資金調達が進んでいくかたちになります。
株式の最大の希釈化率は、発行済株式数の25パーセントに抑えており、想定調達額は約8億2,000万円です。資金使途としては、脊髄損傷急性期を対象とするアメリカでの臨床・製造開発、新たなパイプラインの創製に資金を充てていきたいと考えています。
海外市場開拓:脊髄損傷急性期を対象とするアメリカでの臨床開発 (資金使途①)
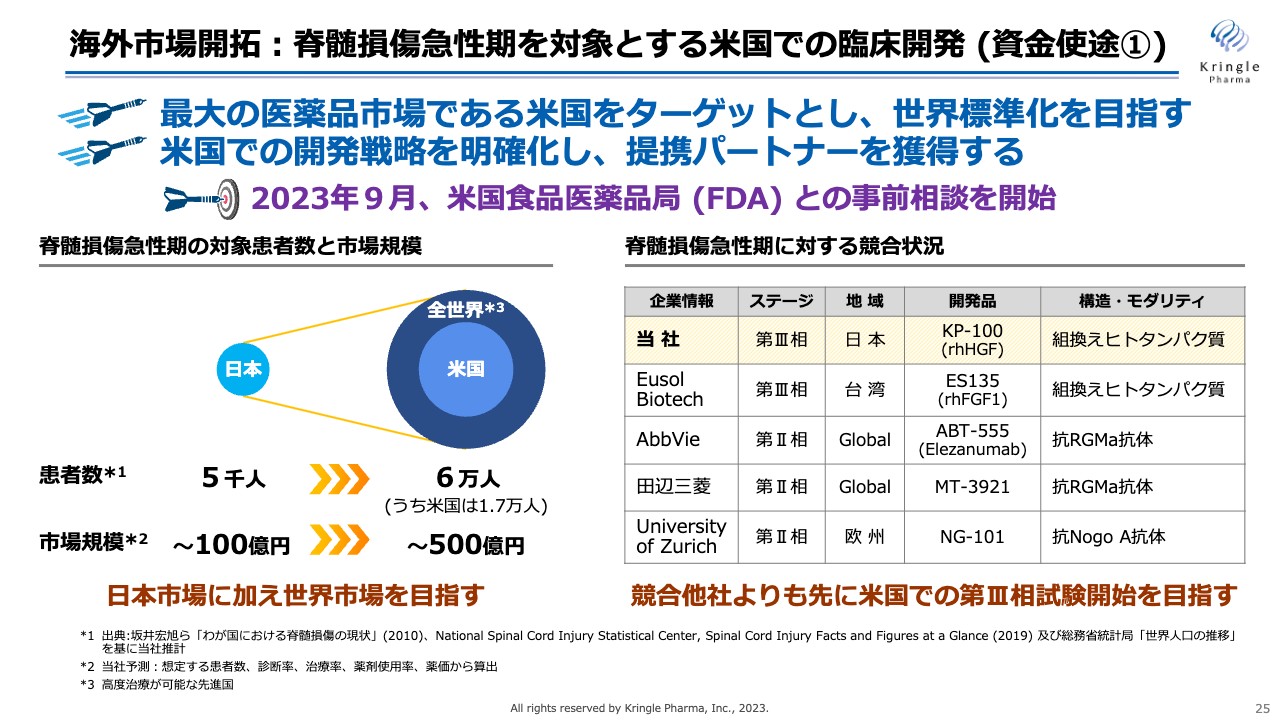
脊髄損傷急性期を対象とするアメリカでの臨床開発です。アメリカは医薬品において最も大きな市場ですので、アメリカでいち早く承認を取ることで、世界標準を目指しています。
すでに海外の製薬・バイオ企業と交渉を進めています。まだ契約の成立には至っていませんが、アメリカ食品医薬品局(FDA)と具体的な交渉をし、その情報を共有することで、提携の交渉を加速できると考えています。
本年9月には、アメリカFDAとpre-INDミーティング(事前相談)を開始しました。先週、FDAから書面の回答を入手し、FDAの考え方を明確化することができました。今後、この情報を交渉相手と共有して、さらに交渉を加速していきたいと考えています。
スライド右側に競合他社の状況をお示ししています。当社は現在、日本で第Ⅲ相試験を実施しているということで先行していますが、アメリカでいち早く第Ⅲ相試験を開始し承認を取ることで、他社に先んじてHGF治療薬を世界標準に仕上げられればと考えています。
海外市場開拓:HGFタンパク質の全世界での安定供給に向けて (資金使途①)

HGFタンパク質の全世界での安定供給に向けて、今後、積極的に活動していきます。当社はすでにHGFタンパク質の医薬品グレードでの製造体制を整えているものの、今後は海外での開発、適応拡大あるいは当社がHGFを供給しているクラリス社の開発進捗に合わせて、ヒトHGFタンパク質がさらに必要になってくる状況が想定されます。これに対応するために、スライド下部の図のような、製造方法の効率化に着手します。
こちらについては、本年9月にクラリス社と新たな契約を締結し、協業して効率化を進めていくということで、すでにプロジェクトがスタートしています。
HGFはバイオ医薬品です。細胞を培養し、そこからHGFを作製していますが、今回の協業により、HGFをさらに高発現する細胞株を作製し、培養・精製工程についても現在よりさらに効率的なプロセスを確立することで、今後の組換えヒトHGFタンパク質の必要量増大に対応できると考えています。
適応拡大:新規パイプラインの創製 (資金使途②)

適応拡大についてご説明します。HGFはすでにさまざまな基礎研究の成果があり、スライド右側に記載しているような疾患において、動物モデルで効果があることが論文として発表されています。適応拡大によりHGFの価値を最大化することが、私たちの成長戦略の大きな柱となっています。
脊髄損傷急性期から慢性期への展開-慶應義塾大学との共同研究-
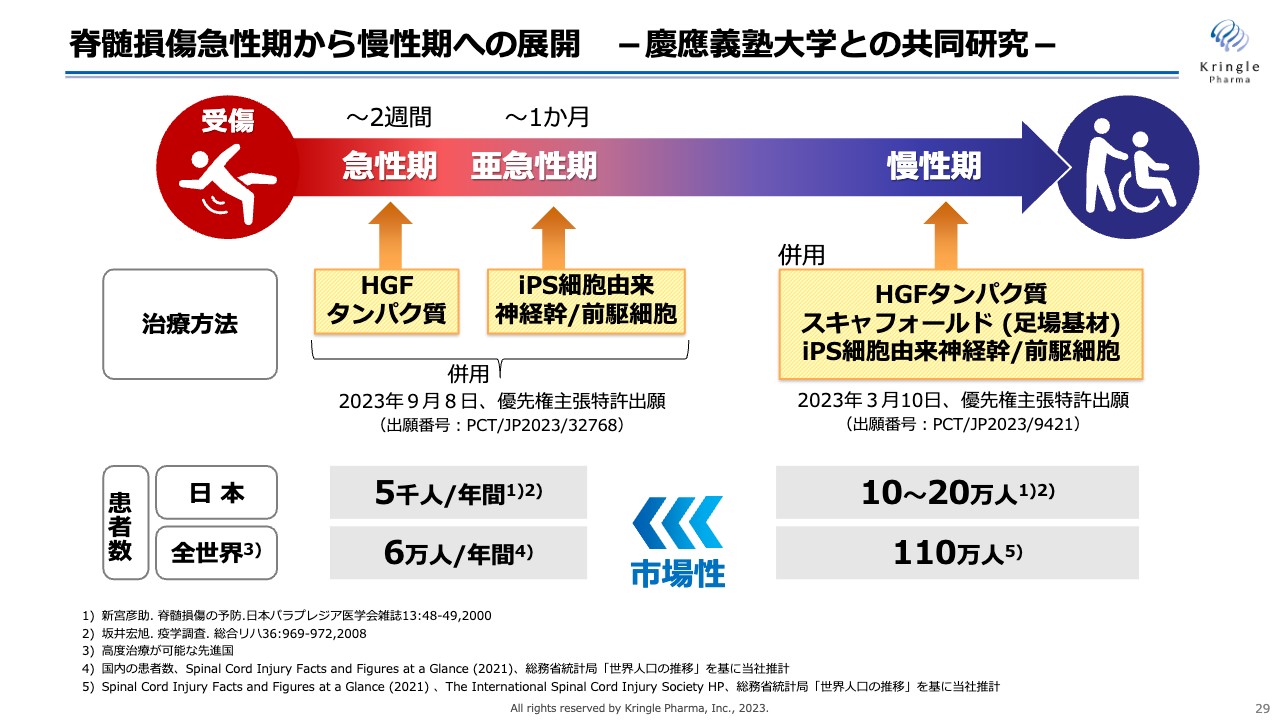
適用拡大に向けては、2本の柱を考えています。その1本目が脊髄損傷急性期から慢性期への展開です。慶応義塾大学との共同研究で、最終的に慢性期の患者にもHGFを使っていただけるような開発をしたいと思っています。
患者数としては、急性期の方に対して、すでに脊髄損傷になっている慢性期の方は約20倍いますので、最終的にはこのような患者にこの薬を届けたいと考えています。
慢性期完全脊髄損傷ラットモデルにおけるHGFと細胞移植の併用効果
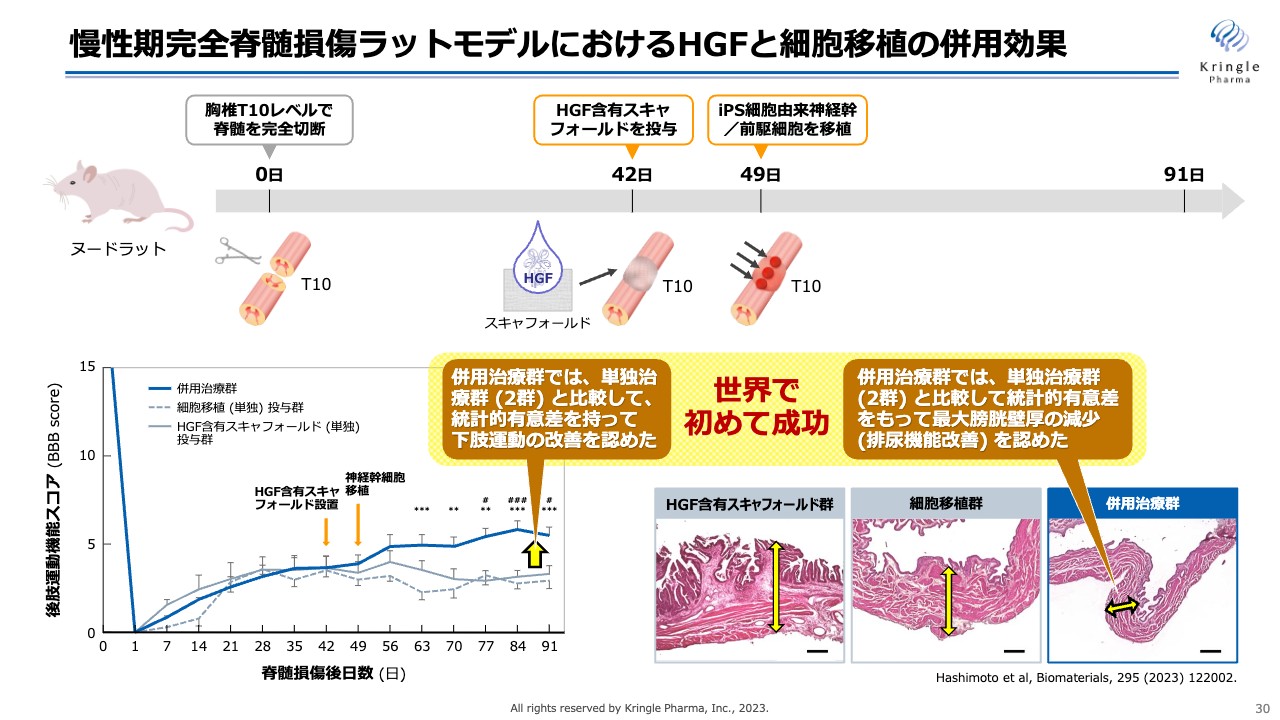
動物モデルにおける成果として、慢性期の完全脊髄損傷のラットモデルでの成果をご紹介します。こちらは完全脊髄損傷ですので、脊髄をはさみで切断するという最も重度なモデルです。これに対して、42日目にスキャフォールドという機材にHGFを染み込ませて、投与します。
その1週間後に、iPS細胞を移植します。事前にHGFを投与することで、再生しやすい環境が整えられ、iPS細胞の生着率が劇的に上昇しました。
最終的に、スライド左下のグラフにある運動機能を見ると、併用治療群は、単独投与群に比べて後肢運動機能の大幅な回復が観察されました。
また、この試験では排尿機能も観察しています。膀胱壁の厚さを測ることによって、併用治療群で排尿機能が改善していることも確認しています。これらは世界で初めて成功した事例であり、『Biomaterials(バイオマテリアルズ)』という非常にレベルの高い科学誌に論文が掲載されています。
脊髄損傷急性期のHGF投与と亜急性期の細胞移植の併用効果
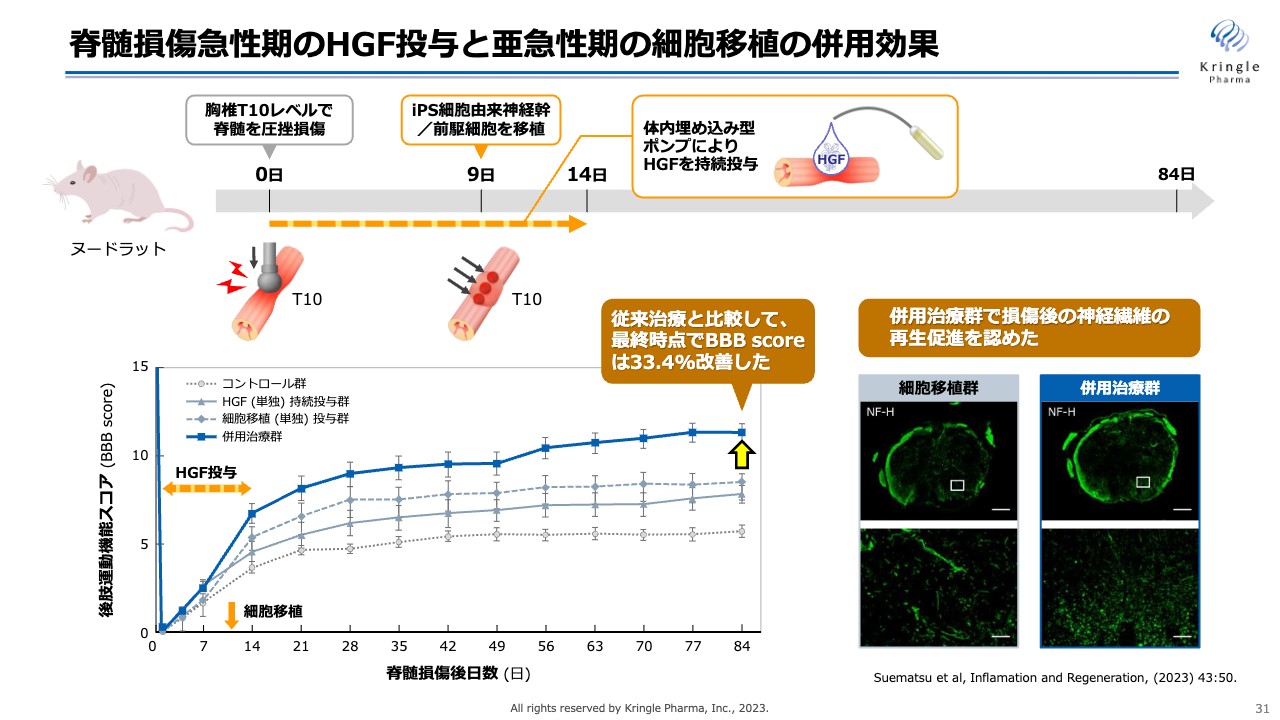
もう1つが、急性期のHGFと亜急性期の細胞移植を組み合わせた動物モデルでの成果です。こちらは、脊髄を圧挫損傷するモデルで、損傷直後から2週間にわたってHGFを投与します。
その間の9日目にiPS細胞を移植しますが、こちらでもHGFを事前に投与することによって細胞の生着率が向上して再生しやすい環境になり、後肢運動機能スコアにおいても、iPS細胞の効果をさらに高められることが確認されました。染色では神経繊維の再生が促進されることも認められています。
先ほどの慢性期のデータと併せて論文を提出し、特許を出願して、将来の権利化を目指します。
適応拡大:声帯瘢痕から他の線維化疾患への展開
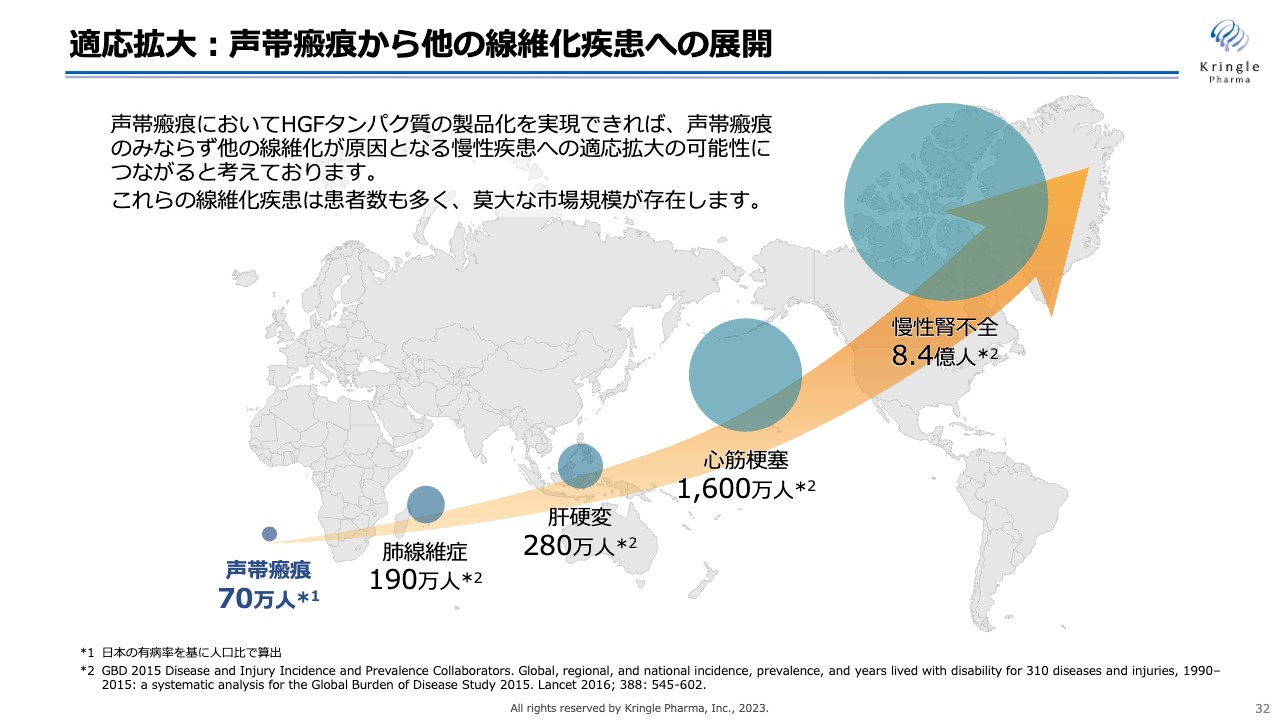
適応拡大のもう1本の柱は線維化疾患への展開です。私たちが今、第Ⅲ相試験を行っている声帯瘢痕は線維化疾患の一種です。患者数は少ないものの、まずはこちらでHGFを医薬品として仕上げて、そこから患者数の多い肺線維症、肝硬変、心筋梗塞、慢性腎不全などに適応を拡大していく戦略をとっています。
収益イメージ図

以上、海外市場開拓、適応拡大によって中長期的な成長を遂げていくことを目指します。
2023年9月期通期 経営成績の概況
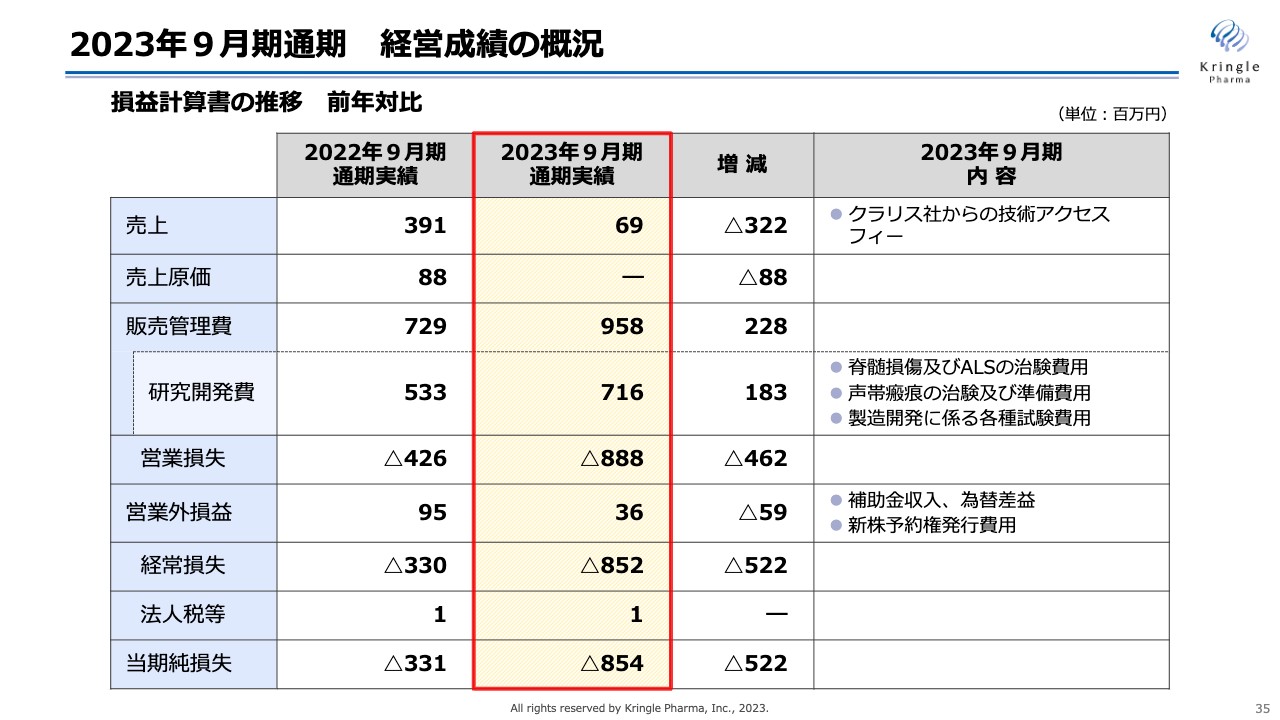
2023年9月期通期決算概況及び2024年9月期業績予想について、ご説明します。まず、2023年9月期の経営成績の概況です。損益計算書の推移を前年対比でお示ししています。
売上は6,900万円で、内容としては、クラリス社からの技術アクセスフィーによるものです。前期は3億9,100万円で、技術アクセスフィーのほかにHGFの供給に係る対価があったものの、当期はHGFの供給がなかったため、技術アクセスフィーのみとなっています。
販売管理費は9億5,800万円、うち研究開発費が7億1,600万円となっており、前期と比べて1億8,300万円増加しています。こちらは主に脊髄損傷急性期、ALS、声帯瘢痕の開発が進捗したことに加えて、承認申請に向けた製造開発に係るさまざまな試験を行ったことで、大きく膨らんでいます。
営業損失はマイナス8億8,800万円、当期純損失もそれが反映された数字となっています。
2023年9月期通期 経営成績の概況

業績予想との対比をお示ししています。売上については、当初の予想とほぼ同等の着地です。大きな差異は研究開発費です。当初8億3,300万円と想定していたものの、最終的には前年比マイナス1億1,700万円の7億1,600万円の着地となりました。要因としては、HGFの製造開発に係る試験において、必要ない承認申請は実施しなかったこと、新規パイプライン関連費用で未発生のものがあったことが挙げられます。
この影響で、販売管理費は前年比マイナス1億400万円の9億5,800万円となり、営業損失、当期純損失にも反映されています。
2023年9月期通期 財政状態の概況

財政状態の概況です。貸借対照表の概要を前期末対比でお示ししています。流動資産は26億1,700万円、うち現預金が21億3,600万円となっています。現預金のマイナスについては、研究開発費の支出による減少が主なもので、これによって流動資産全体がマイナスとなり、資産合計は26億1,800万円となっています。
負債については流動負債が2億900万円、こちらは製造開発に係る未払い金の増加によるものです。固定負債は3億8,700万円と前期より1億3,100万円増えていますが、AMED(国立研究開発法人日本医療研究開発機構)からの受取補助金に対応する長期預り金の増加によるものです。
負債合計は5億9,600万円、純資産合計が20億2,100万円、負債純資産合計は26億1,800万円となっています。自己資本比率は前期末に比べ減少していますが、引き続き健全な財政状態をキープしています。
2023年9月期通期 キャッシュ・フローの概況
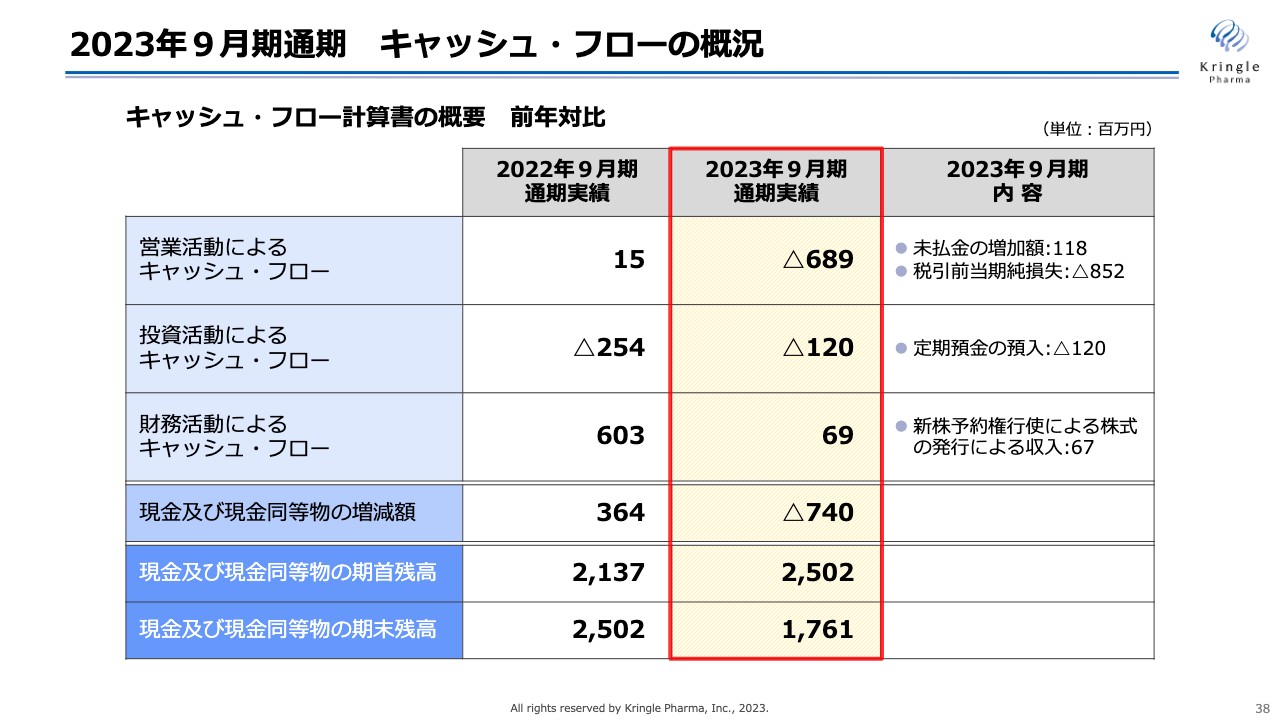
キャッシュ・フローの概況です。営業活動によるキャッシュ・フローはマイナス6億8,900万円となりました。内訳は、未払金の増加と税引前当期純損失のマイナスが計上されています。
投資活動によるキャッシュ・フローはマイナス1億2,000万円となりました。こちらは、AMEDのCiCLE(医療研究開発革新基盤創成事業)で補助金額と同額の定期預金を預け入れる制度になっているため、1億2,000万円が計上されています。
財務活動によるキャッシュ・フローは6,900万円となりました。今年9月から新株予約権発行による資金調達がスタートしているため、株式発行による1ヶ月分の収入が計上されています。
現金及び現金同等物の増減額はマイナス7億4,000万円、期末残高は17億6,100万円となっています。
2024年9月期 業績予想
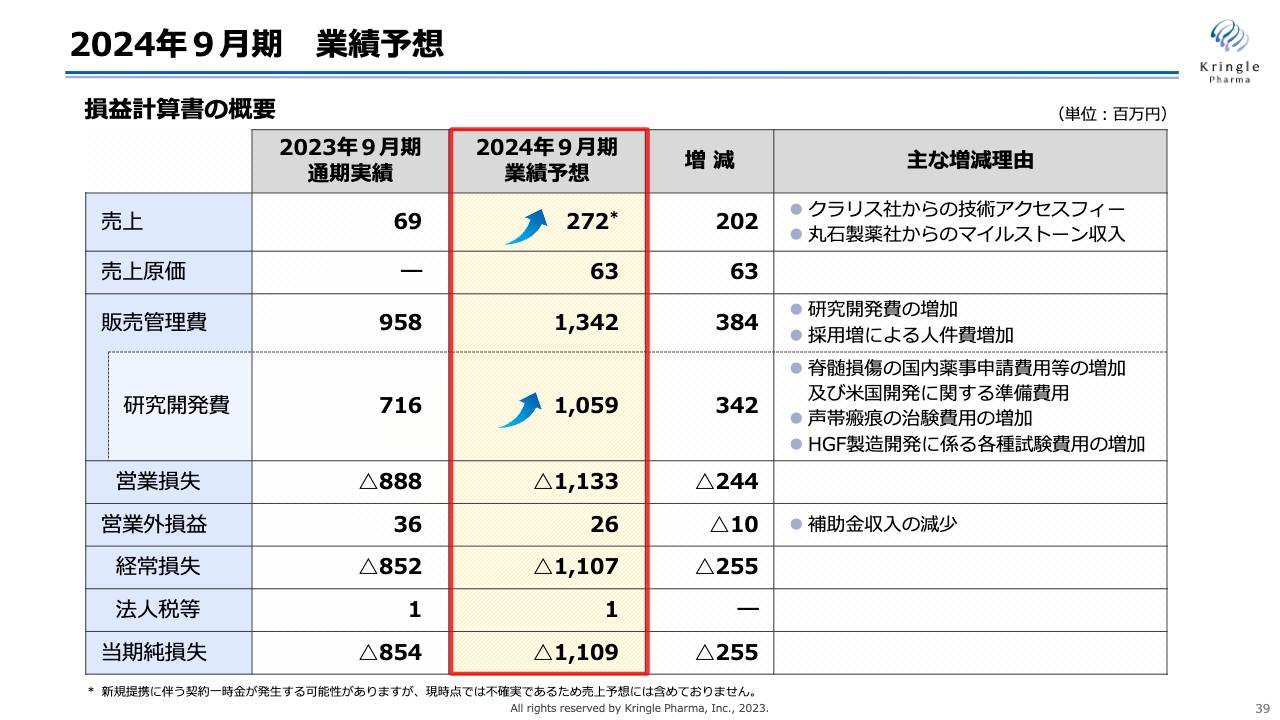
2024年9月期の業績予想です。売上は、クラリス社からの技術アクセスフィーに加え、丸石製薬社からのマイルストーン収入を予想しています。このマイルストーン収入は、国内の脊髄損傷急性期に係る承認申請時の収入であり、これらを合わせて、売上は2億7,200万円を予想しています。
また、後ほど内訳を示しますが、脊髄損傷急性期の国内開発や海外での開発準備、声帯瘢痕の治験費用などが増大するため、研究開発費は前年比プラス3億4,200万円の10億5,900万円を予想しています。こちらに応じて、販売管理費は13億4,200万円、営業損失は11億3,300万円、当期純損失は11億900万円を予想しています。
2024年9月期 業績予想 -研究開発費の内訳-
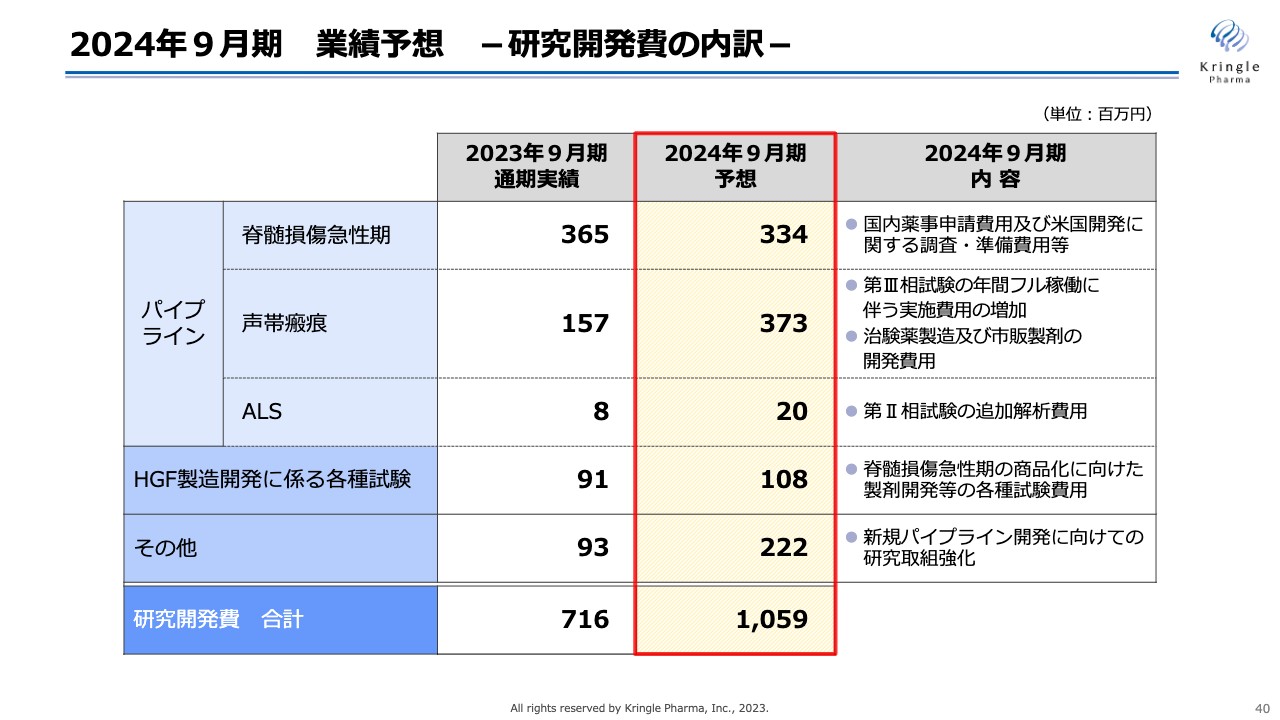
研究開発費10億5,900万円の内訳です。脊髄損傷急性期は、国内薬事申請及びアメリカでの開発準備に関する費用で3億3,400万円を予想しています。
声帯瘢痕は、現在第Ⅲ相試験がフル稼働しているため、前期と比較して費用が増加しており、3億7,300万円を予想しています。ALSは、今期に追加解析を行うための費用を計上しています。
HGF製造開発に係る各種試験では、承認申請に向けてさまざまな試験を行うための費用を計上しています。
その他では、新たなパイプラインを積極的に開発していくため、前期よりも大きな数字を計上しています。これらの研究開発費を合計し、10億5,900万円を予想しています。
クリングルファーマのビジョン
最後は、いつもお示ししているスライドです。当社のビジョンは「患者さんに新薬を、人々に笑顔を」届けることです。まずはHGFを社会実装し、難病の患者に対して確実に医薬品を届ける点にフォーカスして事業を進めていきます。
同時に、適応拡大と海外展開を着実に成し遂げ、創薬バイオベンチャーからバイオ製薬企業へ成長を目指していきます。
みなさまには引き続きご支援ご鞭撻を賜りたく、今後ともどうぞよろしくお願いします。ご清聴いただき、ありがとうございました。
質疑応答:国内での脊髄損傷急性期の製造販売承認申請の実施時期について

司会者:「今期の見通しの中で、国内での脊髄損傷急性期の製造販売承認申請を予定しているようですが、いつごろを想定しているのでしょうか?」というご質問です。
安達:国内での脊髄損傷急性期の開発は、いよいよ第Ⅲ相試験が終わりに近づいています。2024年の承認申請を目指して進めていますが、具体的な申請時期はPMDA(独立行政法人医薬品医療機器総合機構)との相談結果によるため、現時点で確定的な日付をお伝えすることが難しいことをご理解いただければと思います。
2024年9月期後半には申請できるのではないかと考えており、そこに向けて抜かりなく準備を進めているところです。
質疑応答:脊髄損傷急性期第Ⅲ相試験の結果の開示時期について

司会者:「脊髄損傷急性期第Ⅲ相試験の結果はいつごろ開示されるのでしょうか?」というご質問です。
安達:第Ⅲ相試験の結果については、みなさま大変心待ちにしていることと思いますし、私たちも同様です。現在はデータ固定の作業を進めているところで、それが終わり次第、解析に入る予定です。
現時点では、第2四半期である来年1月から3月の間には、トップラインデータを開示できるのではないかと考えています。
質疑応答:クラリス社と行うアメリカでのHGF原薬製造開発の進捗について

司会者:「今回の資金調達の使途にもなっている、クラリス社と提携してアメリカでのHGF原薬の製造開発を行うという話は、具体的にはどこまで進んでいるのでしょうか?」というご質問です。
安達:本件については今年9月にリリースも出していますが、クラリス社と協業して製造の効率化を図っていくことになっています。具体的には、高発現株の作製あるいは培養、精製工程の効率化を進めていくのですが、現在はさまざまな予備試験などを行っている段階です。具体的な進捗があり次第、適宜開示します。
質疑応答:声帯瘢痕のオーファン指定に関する申請の有無について

司会者:「声帯瘢痕のオーファン指定に関して特に開示がありませんが、申請自体はされているのでしょうか?」というご質問です。
安達:スライドに日本のオーファン指定の品目についてまとめていますが、声帯瘢痕の患者は5万人未満のため、オーファン指定の対象になると考えています。すでに厚生労働省と何度か事前相談を重ねていますが、まだ厚生労働省から指定要件についての正式な回答が得られていない状況です。
こちらも進展があり次第、適宜開示しますので、もうしばらくお待ちいただければと思います。
質疑応答:ALS第Ⅱ相試験の追加解析の進捗と結果の公表時期について

司会者:「ALS第Ⅱ相試験の追加解析を行うとのことですが、現在はどこまで進んでいるのでしょうか? 追加解析の結果はいつ公表されるのでしょうか?」というご質問です。
安達:前回の決算説明会でも、ALSの第Ⅱ相試験に関するスライドをお示しし、バイオマーカーの評価を中心とした追加解析を行うとお話ししました。
第Ⅱ相試験は医師主導治験として行っているため、治験で得られた検体を用いる追加解析も、基本的には東北大学が主導する臨床研究として行う必要があります。当社との共同研究のもとで臨床研究を進めることになりますが、進捗としては、東北大学の倫理委員会において追加解析の計画に承認が下りたため、いよいよ試験計画を細かく定めていきます。現在は業者ともやり取りをしており、具体的に進められる段階まできています。
こちらも今期中には追加解析を終えて結果をお示ししたいと考えていますし、この結果をもとに、次の開発を進める提携パートナーを得られるような方針で進めていきたいです。
質疑応答:アメリカでの治験開発準備の対象について

司会者:「現在進めているアメリカでの治験開発準備は、脊髄損傷急性期が対象でしょうか? それとも亜急性期を対象としているものでしょうか?」というご質問です。
安達:脊髄損傷急性期を対象としています。当社はこれまでに国内で脊髄損傷急性期を対象に第Ⅰ/Ⅱ相試験を終了しており、第Ⅲ相試験もまもなく終了する段階まできているため、アメリカでの開発では、まずは急性期を対象としたHGFの単剤での開発を目指しています。海外では、提携パートナーを得て共同開発を進めるかたちを想定しています。
これまでの交渉の中では、どのように考えるかという質問に対してFDAからなかなか答がない状況でしたが、2023年9月にFDAへ実際にアプローチし、先週にはpre-INDミーティングで書面の回答を入手したため、アメリカでの開発戦略をさらに明確化することができました。
こちらを材料に、提携パートナーとの交渉を加速させて成約までもっていきたいと考えています。
質疑応答:国内での脊髄損傷急性期の治験がうまくいかなかった場合の、アメリカでの開発への影響について
司会者:「仮に、国内での脊髄損傷急性期の治験がうまくいかなかった場合、アメリカでの治験開発も中止になるのでしょうか?」というご質問です。
安達:この度、アメリカのFDAとのpre-INDミーティングで書面回答を得ましたが、日本のPMDAとアメリカのFDAが考えていることには、共通する部分もあれば、相違する部分もあることがわかりました。
したがって、アメリカでの開発においては、FDAが考える治験デザインを考える必要があります。基本的に、FDAはアメリカでの開発の結果をもとに承認申請の判断をすることになるため、一義的には日本の開発とアメリカの開発は別物になります。
もちろん、日本での開発結果はアメリカでの開発の参考にはなりますが、直結するものではないと考えています。
質疑応答:慶応大学との共同開発に関する事業化の目処について

司会者:「慶応義塾大学と共同開発している脊髄損傷に関して、複数の論文執筆や特許共同出願などを行われていますが、今後の事業化の目処を教えてください」というご質問です。
安達:今期は、慶応義塾大学との共同研究で非常にすばらしい結果を得ることができました。慶応義塾大学の先生方が常におっしゃっていることですが、脊髄損傷は急性期から亜急性期、そして慢性期と、刻一刻と患者の病態が変化していきます。
そのような状況の中で、単一の薬剤または細胞治療、あるいはリハビリテーションだけですべてが解決するような、生やさしいものではありません。しかるべきタイミングでしかるべき薬剤を投与したり、細胞を使用したりすることで、初めて患者にベネフィットをもたらすことができます。
今回の動物モデルでの結果は非常に重要な成果です。慢性期にHGFタンパク質だけではなかなか効果が見込めず、また、iPS細胞の単独投与だけでは効果が認められませんでしたが、これらを合わせ、かつスキャフォールドという足場基材を加えることによって、これまで回復が得られなかったモデルにも回復が得られました。
この結果は、すでに脊髄損傷によって不自由があり困っている方にとって非常に大きな希望の光になると思っているため、1日でも早く臨床試験開発に進めて実用化したいと考えていますが、まだ動物モデルでの段階であることから、時間がかかります。今後も慶応義塾大学の先生方と協議を進め、急性期、慢性期でもHGFが活用できるようにしていきたいと考えています。
質疑応答:声帯瘢痕の治験の進捗について

司会者:「声帯瘢痕の治験の進捗について、施設の追加以降は特に新しい情報の開示がされていませんが、現在の進捗状況は順調でしょうか?」というご質問です。
安達:声帯瘢痕について、現在は5施設で症例の組入れを行っている段階です。組入れがスタートする段階で契約などの対応が発生し、当初の想定よりも時間がかかりました。今後は組入れを強化していきたいと思っています。
治験施設をさらに増やす可能性も視野に入れているため、2024年の後半にはなんとか組入れを終了するべく、努力を続けているところです。
質疑応答:クラリス社が実施している第Ⅰ/Ⅱ相試験の終了予定時期について
司会者:「クラリス社がアメリカで実施している第Ⅰ/Ⅱ相試験は、いつ終了する予定でしょうか?」というご質問です。
安達:クラリス社は、神経栄養性の角膜炎を対象として、現在はアメリカとカナダで第Ⅰ/Ⅱ相試験を行っています。
プラセボ対照二重盲検比較試験ですが、こちらについてはクラリス社との守秘義務があるため、当社から詳細を開示することは差し控えたいと思います。クラリス社のホームページには2024年2月に試験終了予定と記載されているため、2024年の前半には試験が終了できるのではないかと思われます。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4884
|
410.0
(13:38)
|
+9.0
(+2.24%)
|
関連銘柄の最新ニュース
-
[PTS]ナイトタイムセッション17時30分時点 上昇98銘柄・下... 03/09 17:33
-
クリングル(4884) 2026年9月期第1四半期決算レポート更新... 03/03 12:10
-
クリングル(4884) 第三者割当により発行された第16回新株予約... 03/02 10:00
-
クリングル(4884) 「2026年9月期 第1四半期決算説明」の... 02/16 11:40
-
クリングルファーマ、米国子会社Kringle Pharma USA... 02/16 11:00
新着ニュース
新着ニュース一覧-
今日 14:03
-
今日 14:01
-
今日 14:01

